Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

104,48gam104,48gam
Giải thích các bước giải:
Sơ đồ phản ứng:
⎧⎪ ⎪ ⎪⎨⎪ ⎪ ⎪⎩AlMgFeOFe3O4+HNO3−−−−−→⎧⎪ ⎪ ⎪ ⎪ ⎪ ⎪⎨⎪ ⎪ ⎪ ⎪ ⎪ ⎪⎩NO,N2OH2O⎧⎪⎨⎪⎩Al(NO3)2Mg(NO3)2Fe(NO3)2to→⎧⎨⎩Al2O3MgOFe2O3+NO2+O2{AlMgFeOFe3O4→+HNO3{NO,N2OH2O{Al(NO3)2Mg(NO3)2Fe(NO3)2→to{Al2O3MgOFe2O3+NO2+O2
Oxi chiếm 20,22%20,22% khối lượng hỗn hợp.
mO=25,32%.25,32=5,12gammO=25,32%.25,32=5,12gam
→nO=0,32mol→nO=0,32mol
Gọi số mol của NONO và N2ON2O lần lượt là xx và yy mol
⎧⎨⎩x+y=3,58422,4=0,16mol30x+44y=0,16.2.15,875→{x=0,14y=0,02{x+y=3,58422,4=0,16mol30x+44y=0,16.2.15,875→{x=0,14y=0,02
Quy đổi hỗn hợp X thành các nguyên tố: Al,Mg,Fe,OAl,Mg,Fe,O
→mKl=25,32−5,12=20,2g→mKl=25,32−5,12=20,2g
→mO(cr)=30,92−20,2=10,72gam→mO(cr)=30,92−20,2=10,72gam
→nO=0,67mol→nO=0,67mol
3nAl+3nFe+2nMg=2nO(cr)3nAl+3nFe+2nMg=2nO(cr)
Gọi số mol của NH4NO3NH4NO3 là xx mol
Bảo toàn e:
3nAl+3nFe+2nMg=2nO+8nNH4NO3+3nNO+8nN2O3nAl+3nFe+2nMg=2nO+8nNH4NO3+3nNO+8nN2O
0,67.2=2.0,32+8nNH4NO3+3.0,14+0,02.80,67.2=2.0,32+8nNH4NO3+3.0,14+0,02.8
→nNH4NO3=0,015mol→nNH4NO3=0,015mol
Khối lượng muối:
m=mKl+mNO−3+mNH4NO3m=mKl+mNO3−+mNH4NO3
=20,2+0,67.2.62+0,015.80=104,48gam

Sau pứ còn chất rắn => Tạo muối Fe2+, Cu2+
Gọi x, y là số mol Fe2O3 và Cu pứ.
Fe2(3+) + 2e -----> 2Fe2+
x.................2x
Cu ------> Cu2+ + 2e
y.............................2y
Ta có:
160x + 64y = 25.6 - 2
2x = 2y
=> x = y = 59/560
Lọc kết tủa nung nóng trong kk thu dc chất rắn là Fe2O3
=> mFe2O3 = 59/560*160 = 16.86g

Câu 1 : Qua nhận xét về phân tử khối và liên kết hidro trong mỗi hợp chất, ta có :
Thứ tự : Axit > Ancol > Este > Hidrocacbon
Ta thấy : Glyxin ở dạng ion lưỡng cực nên có nhiệt độ sôi cao hơn axit propionic
Vậy, theo chiều tăng dần nhiệt độ sôi, nhiệt độ nóng chảy là :
Glyxin > Axit propionic > Butan-1-ol >Metyl axetat > Butan

nHNO3 = 0,08.1 =0,08 mol
3Cu + 8HNO3 ➝ 3Cu(NO3)2 + 2NO +4H2O
0,03←0,08 → 0,03 → 0,02
⇒ nCu = 0,03 ⇒ m = mCu = 1,92 g
nNO = 0,02 ⇒ VNO = 0,02.22,4= 4,48l
(Cu tác dụng với HNO3 loãng thì thường sinh ra khí NO còn HNO3 đặc thì sinh ra khí NO2)
b) m muối = mCu(NO3)2 = 0,03.188 = 5,64g
c) Cu(NO3)2 ➝ CuO + NO2 +O2
áp dụng định luật bảo toàn nguyên tố nCuO = nCu(NO3)2 = 0,03 mol
⇒ mCuO = 0,03.80 =2,4 g

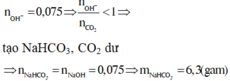
Đáp án C
Khi phản ứng với 0,4 mol NaOH thì sẽ thu được 0,15 mol Na2CO3 và còn 0,1 mol NaOH dư
=> Đáp án C