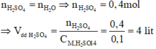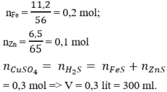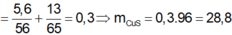Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(H_2S + CuSO_4 \to CuS + H_2SO_4\)
\(n_{H_2S} = n_{CuSO_4} = \dfrac{800.1,2.10\%}{160} = 0,6(mol)\\\)
Gọi : \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\)⇒ 56x + 65b = 37,2(1)
\(Fe +S \xrightarrow{t^o}FeS\\ Zn + S\xrightarrow{t^o}ZnS\\ FeS + 2HCl \to FeCl_2 + H_2S\\ ZnS + 2HCl \to ZnCl_2 + H_2S\\\)
Theo PTHH :
\(n_{H_2S} = a + b = 0,6(2)\)
Từ (1)(2) suy ra a = 0,2; b = 0,4
Vậy :
\(m_{Fe} = 0,2.56 = 11,2(gam)\\ m_{Zn} = 0,4.65 = 26(gam)\)

Đáp án B.
nFe = 0,2 mol; nZn = 0,1 mol
NaOH + H2S→NaHS + H2O
![]()

Ta có: \(n_{SO_2}=\dfrac{12,395}{24,79}=0,5\left(mol\right)\)
BTNT S, có: nH2SO4 = nSO3 = nSO2 = 0,5 (mol)
Mà: mH2SO4 (ban đầu) = 210.10% = 21 (g)
⇒ mH2SO4 (trong X) = 21 + 0,5.98 = 70 (g)
Có: m dd X = 210 + mSO3 = 210 + 0,5.80 = 250 (g)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{70}{250}.100\%=28\%\)

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
Phương trình hóa học của phản ứng:
Zn + S → ZnS
Fe + S → FeS
ZnS + H2SO4 → ZnSO4 + H2S
FeS + H2SO4 → H2S + FeSO4

Đáp án D
Các phương trình phản ứng:
Hỗn hợp kim loại tác dụng với oxi:
Au, Ag không tác dụng với oxi
![]()
Phương trình phản ứng :
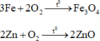
Rắn X gồm Au, Ag, CuO, Fe3O4 và ZnO tác dụng với dung dịch H2SO4 loãng:
Au, Ag không tác dụng với dung dịch H2SO4 loãng
![]()
Phương trình phản ứng
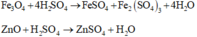
Tính toán:
Gọi M là kim loại chung cho Cu, Fe và Zn với hóa trị n
Sơ đồ phản ứng :
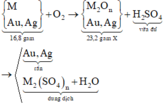
Bảo toàn khối lượng cho giai đoạn hỗn hợp kim loại tác dụng với oxi:
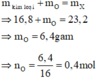
Theo sơ đồ thì cuối cùng O chuyển hết về O trong H2O. Bảo toàn nguyên tố O ta có:
n H 2 O = n O ⇒ n H 2 O = 0 , 4 mol
Bảo toàn nguyên tố H ta có: