K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

16 tháng 11 2018
Đáp án C
Các phản ứng xảy ra:
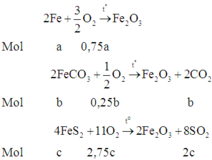
Vì áp suất trước và sau phản ứng không đổi nên số mol khí phản ứng bằng số mol khí sinh ra (tổng thể tích khí trong bình không thay đổi).
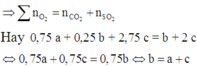

15 tháng 7 2017
![]() Hỗn hợp anken hết trước, hiệu suất tính theo anken
Hỗn hợp anken hết trước, hiệu suất tính theo anken
Ta có: ![]() (vì n = pV/RT suy ra n tỉ lệ thuận với p)
(vì n = pV/RT suy ra n tỉ lệ thuận với p)
(trong đó n1, p1 là số mol và áp suất hỗn hợp lúc đầu, n2, p2 là số mol, áp suất hỗn hợp lúc sau)
![]()
Số mol hỗn hợp sau:
![]()
Số mol khí giảm
![]()
Vậy hiệu suất ![]()
Đáp án B.

4 tháng 8 2017
Đáp án C.
STUDY TIP: Việc đặt số mol hỗn hợp ban đầu bằng 1 mol giúp quá trình tính toán đơn giản hơn, do đó nó rất hiệu quả để giải nhanh các bài tập trắc nghiệm.

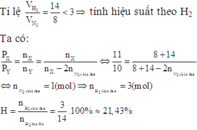
Tham Khảo
8Ba + NH4NO3 —> Ba3N2 + 3BaO + 2BaH2
0,8………………………0,1………0,3………0,2
Ba3N2 + 6H2O —> 3Ba(OH)2 + 2NH3
0,1………………………………………0,2
BaO + H2O —> Ba(OH)2
BaH2 + 2H2O —> Ba(OH)2 + 2H2
0,2………………………………….0,4
Khí B gồm NH3 (0,2) và H2 (0,4) —> nB = 0,6
Áp suất tăng 10% nên số mol tăng 10% —> Số mol khí lúc cân bằng = 0,6 + 0,6.10% = 0,66 mol
2NH3 <—-> N2 + 3H2
0,2……………0…….0,4
2x…………….x……..3x
0,2-2x……….x……0,4+3x
—> (0,2 – 2x) + x + (0,4 + 3x) = 0,66
—> x = 0,03
Vậy ở trạng thái cân bằng hỗn hợp khí gồm:
NH3: 0,2 – 2x = 0,14 mol (21,21%)
N2: x = 0,03 mol (4,55%)
H2: 0,4 + 3x = 0,49 mol (74,24%)