Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích: Đáp án D
Zn + Cu2+ -> Zn2+ + Cu
=> mgiảm = (65 – 64)x = 0,1g
=> x = 0,1 mol = nZn pứ
=> mZn pứ = 6,5g

Đáp án D.
Gọi x là số mol Fe phản ứng
Fe + CuSO4 → FeSO4 + Cu
1,2 = 64x – 56x → x = 0,15
Khối lượng Cu mCu = 0,15 x 64 = 9,6 (g)

Đáp án B
Bảo toàn ne=> 3nAl = 2nH2=> nAl = 0,1 => %mAl = 0,1.27.100%/5 = 54%

\(Gọi:n_{Fepứ}=x\left(mol\right)\\ Fe+CuSO_4\rightarrow FeSO_4+Cu\\ m_{tăng}=m_{Cu}-m_{Fe}=64x-56x=1,2\\ \Rightarrow x=0,15\left(mol\right)\\ \Rightarrow m_{Cu}=0,15.64=9,6\left(g\right)\\ \Rightarrow ChọnD\)

HD:
Zn + CuSO4 ---> ZnSO4 + Cu
x x mol
Gọi x là số mol Zn đã phản ứng. Khối lượng thanh Zn giảm = khối lượng Zn đã phản ứng trừ đi khối lượng Cu sinh ra bám vào thanh Zn.
Do đó: 65x - 64x = 0,15 suy ra x = 0,15 mol = số mol CuSO4. Do đó, CM = 0,15/0,5 = 0,3 M.

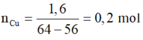

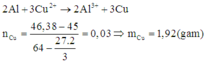
Zn+CuSO4->ZnSO4+Cu
n znpu=a
=>m giảm =65a-64b-0,28
=>a=0,28
=>m Zn=0,28.65+7,8=26g
B