Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : D
Catot : Cu2+ + 2e -> Cu2+
Anot : 2H2O -> 4H+ + O2 + 4e
Do dung dịch vẫn còn màu xanh nên Cu2+ dư
=> nH+ = 2nCu = 0,25 mol
Khi cho Fe vào thì :
Fe + 2H+ -> Fe2+ + H2
0,125 <- 0,25 mol
Fe + Cu2+ -> Fe2+ + Cu
.x <- x
=> mFe bđ – mKL sau = 56.(0,125 + x) – 64x = 16,8 – 12,4
=> x = 0,325 mol
=> nCu2+ bđ = 0,125 + 0,325 = 0,45 mol
=> CM (CuSO4) = 2,25M

Do dd Y vẫn còn màu xanh => Cu2+ chưa điện phân hết. Gọi a là số mol đã Cu2+ điện phân.
Cu2+ + 2e ---> Cu
a............2a.........a
2H2O ---> 4H+ + O2 + 4e
.................2a.....0.5a....2a
Ta có: mgiảm = mCu + mO2
=> 64a + 0.5a*32 = 8 => a = 0.1
nCu2+ chưa đp = 0.2x - 0.1
Fe + 2H+ --->....
0.1....0.2
Fe + Cu2+ ----> Cu
0.2x-0.1.............0.2x-0.1
mFe bđầu - mFe pứ acid + mtăng do Fe + Cu2+ = mkl
=> 16.8 - 0.1*56 + 8*(0.2x - 0.1) = 12.4
=> x = 1.25
=> Đáp án D

Đáp án : C
Vì ngâm lá sắt vào dung dịch sau điện phân thấy khối lượng tăng => chứng tỏ Cu2+ còn dư
Catot : Cu2+ + 2e -> Cu
Anot : 2H2O -> 4H+ + O2 + 4e
,nO2 = 0,05 mol
=> 4nO2 = 2nCu2+ đp => nCu2+ đp = 0,1 mol
Fe + 2H+ -> Fe2+ + H2
0,1 <- 0,2 mol
Fe + Cu2+ -> Fe2+ + Cu
,x -> x -> x
=> mtăng = 64x – 56(x + 0,1) = 0,8g
=> x = 0,8 mol
=> nCuSO4 bđ = 0,1 + 0,8 = 0,9 mol
=> CM(CuSO4) = 1,8M

Đáp án : A
Khi cho Fe vào thấy khối lượng kim loại thu được tăng => Còn Cu2+
+) Catot : Cu2+ + 2e -> Cu
,a -> 2a -> a
+) Anot : 2H2O – 4e -> 4H+ + O2
,2a -> 2a -> 0,5a
=> mgiảm = 4 = mCu pứ + mO2 = 64a + 16a => a = 0,05 mol
Dung Dịch sau điện phân có b mol Cu2+ và 0,1 mol H+
=> mKL sau – mKl trước = mCu – mFe pứ = 64b – 56.( b + 0,1.0,5) = 38,2 – 36,4
=> b = 0,575 mol
=> x = 1,25M

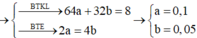
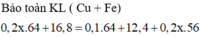

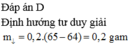

Đáp án A
Zn + CuSO4 → ZnSO4 + Cu
Đặt nZn pứ = a mol → nCu = a mol
Sau khi dung dịch CuSO4 mất màu hoàn toàn thì CuSO4 phản ứng hết.
→ Khối lượng lá Zn giảm là mchất rắn giảm = mZn pứ - mCu sinh ra = 65a - 64a = a = 0,15
→ x = CM CuSO4 = n/Vdd = 0,15: 0,2 = 0,75M