Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
PTHH: Zn + Pb(NO3)2 → Zn(NO3)2 + Pb
(Gọi số mol của Zn là a => Số mol của Pb là a)
Sau 1 thời gian lấy lá kẽm ra thấy khối lượng tăng 1,42 gam = Khối lượng Pb sinh ra bám vào lá kẽm trừ đi khối lượng Zn phản ứng.
<=> 207a - 65a = 1,42
<=> a = 0,01 (mol)
a) Khối lượng chì bám vào kẽm là: 207a = 2,07(g)
b) Đổi: 500 ml = 0,5 l
Số mol của dung dịch Pb(NO3)2 là: 0,5 . 2 = 1 (mol)
So sánh: 0,01 < 1
=> Dung dịch Pb(NO3)2 dư , tính theo Zn
Số mol của Zn(NO3)2 là: 0,01 . 1 = 0,01 (mol)
Nồng độ mol của dung dịch sau khi lấy lá kẽm ra là:
CM = n / V = 0,01 : 0,5 = 0,02M
( Vì thể tích dung dịch k thay đổi đáng kể nên sau phản ứng và lấy lá kẽm ra thì thể tích dung dịch vẫn là 500 ml)
chúc bạn học tốt và nhớ tích đúng cho mình

a) Chì bị giảm là do đã phản ứng 1 phần với CuCl2 tạo muối chì và 1 kim loại với sinh ra (Cu) bám lên miếng chì
b) Pb + CuCl2 → PbCl2 + Cu
Gọi số mol chì phản ứng là x (mol)
\(m_{KLgiam}=10\%.286=28,6\left(g\right)\)
=> \(m_{KLgiam}=m_{Pb\left(pứ\right)}-m_{Cu\left(sinhra\right)}=207x-64x=28,6\)
=> x=0,2
=> \(m_{Pb\left(pứ\right)}=0,2.207=41,4\left(g\right)\); \(m_{Cu\left(sinhra\right)}=0,2.64=12,8\left(g\right)\)
c) \(n_{CuCl_2}=x=0,2\left(mol\right)\)
=> \(CM_{CuCl_2}=\dfrac{0,2}{0,4}=0,5M\)
d) \(n_{PbCl_2}=x=0,2\left(mol\right)\)
\(CM_{PbCl_2}=\dfrac{0,2}{0,4}=0,5M\)

PTHH: \(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
Gọi \(n_{Al\left(p.ứ\right)}=a\left(mol\right)\) \(\Rightarrow n_{Cu}=\dfrac{3}{2}a\left(mol\right)\)
Tăng giảm khối lượng: \(77,6-50=64\cdot\dfrac{3}{2}a-27a\)
\(\Rightarrow a=0,4\) \(\Rightarrow\left\{{}\begin{matrix}n_{Cu}=0,6\left(mol\right)\\n_{Al}=0,4\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Al\left(p.ứ\right)}=0,4\cdot27=10,8\left(g\right)\\m_{Cu}=0,6\cdot64=38,4\left(g\right)\end{matrix}\right.\)

\(Pb+CuCl_2\rightarrow PbCl_2+Cu\)
1mol 1mol 1mol 1mol
0,2 0,2 0,2 0,2 (mol)
Theo PTHH cứ 207g Pb phản ứng thì miếng Pb giảm: 207 - 64 = 143g
Xg --------------- 28,6g
Khối lượng chì PỨ:
\(X=28,6.\frac{207}{143}=41,4\left(g\right)\)
\(n_{PbP\text{Ư}}=\frac{41,1}{207}=0,2\left(mol\right)\)
Theo PTHH nCu: \(0,2mol\)
\(m_{Cu}=0,2.64=12,8g\)
Nồng độ mol CuCl2 phản ứng là:
Theo PTHH nCu: \(0,2mol\)
\(CM=0,2:0,4=0,5M\)
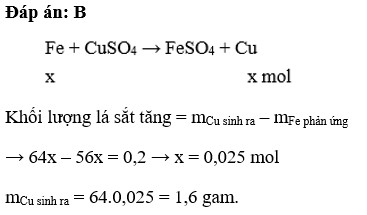
Gọi nPb = a (mol)
PTHH: \(Pb+Cu\left(NO_3\right)_2\rightarrow Pb\left(NO_3\right)_2+Cu\downarrow\)
_______a------------------------------------------>a______(mol)
=> mgiảm = 207a - 64a = 1,43
=> a = 0,01 (mol)
= > mPb = 0,01.207 = 2,07 (g)