Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình phản ứng hóa học:
Al2O3 + 3H2SO4 → Al2(SO4) + 3H2O
102 g 3. 98 = 294 g
Theo phương trình phản ứng ta thấy, khối lượng axit sunfuric nguyên chất tiêu thụ lớn gấp hơn hai lần khối lượng oxit. Vì vậy, 49 gam H2SO4 nguyên chất sẽ tác dụng với lượng nhôm (III) oxi nhỏ hơn 60gam
Vật chất Al2O3 sẽ còn dư và axit sunfuric phản ứng hết.
102 g Al2O3 → 294 g H2SO4
X g Al2O3 → 49g H2SO4
Lượng chất Al2O3 còn dư là: 60 – x = 60 - = 43 g
Trần Thu Hà copy từ trang hoc khác đó cô @Cẩm Vân Nguyễn Thị

a)
2Al+ 3H2SO4 ----> Al2(SO4)3 + 3H2
2 : 3 : 1 : 3
b)
nếu có 6,02.1023 nguyên tử Al thì tác dụng đc với số phân tử H2SO4 là
\(\frac{6,02.10^{23}.3}{2}=9,03.10^{23}\)
số phân tử H2 bằng số phân tử H2SO4=>tạo ra 9,03.1023 phân tử H2
số phân tử của H2SO4 gấp 3 lần số phân tử Al2(SO4)3=> số phân tử của Al2(SO4)3 khi đó là:
9,03.1023:3=3,1.1023
c) nếu có 3,01.1023 nguyên tử Al thì tác dụng đuocx với số phân tử H2SO4 là:
3,01.1023:2.3=4,515.1023phân tử H2SO4
và khi đó tạo ra được số phân tử Al2(SO4)3 là
4,515.1023:3=1,505.1023
khi đó tạo được số phân tử H2 là:
1,505.1023.3=4,515.1023
nhoc quay pha bn có thể giảng lại đc k mk k hiểu cho lắm

a)
\(Zn+H2SO4\rightarrow ZnSO4+H2\)
\(2Al+3H2SO4\rightarrow Al2\left(SO4\right)3+3H2\)
\(Fe+H2SO4\rightarrow FeSO4+H2\)
b) giải sử khối KL cùng là \(m\left(g\right)\)
\(\Rightarrow n_{Zn}=\frac{m}{65}\Rightarrow n_{H_2}=\frac{m}{65}\)
\(\Rightarrow n_{Al}=\frac{m}{27}\Rightarrow n_{H_2}=1,5.\frac{m}{27}\)
\(\Rightarrow n_{Fe}=\frac{m}{56}\Rightarrow n_{H_2}=\frac{m}{56}\)
\(\Rightarrow Al\)
c) Giả sử : \(n_{H_2}=0,15mol\)
\(\Rightarrow n_{Zn}=0,15mol\Rightarrow m=9,75g\)
\(\Rightarrow n_{Al}=0,1mol\Rightarrow m=2,7g\)
\(\Rightarrow n_{Fe}=0,15mol\Rightarrow m=8,4g\)
\(\Rightarrow Al\)

nH2SO4 = 0,5 mol
nAl2O3 = 0,6 mol
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Đặt tỉ lệ ta có
0,6 > \(\dfrac{0,5}{3}\)
⇒ Al2O3 dư
⇒ mAl2O3 dư = ( 0,6 - 0,2 ).102 = 40,8 (g)

PT: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
Số mol Mg tham gia phản ứng là: \(n_{Mg}=\dfrac{1,44}{24}=0,06\left(mol\right)\)
Số mol H2SO4 tham gia phản ứng là: \(n_{H_2SO_4}=\dfrac{4,9}{98}=0,05\left(mol\right)\)
Ta có tỉ lệ: \(\dfrac{0,06}{1}>\dfrac{0,05}{1}\) => Mg dư
Theo phương trình: \(n_{Mg}=n_{MgSO_4}=n_{H_2SO_4}=0,05\left(mol\right)\)
a, Mg dư
Ta có: \(n_{Mgdư}\) = 0,06 - 0,05 = 0,01 (mol)
Khối lượng Mg dư sau phản ứng là: \(m_{Mg}=0,01.24=0,24\left(g\right)\)
b,Khối lượng MgSO4 tạo thành sau phản ứng là:
\(m_{MgSO_4}=0,05.120=6\left(g\right)\)
=.= hk tốt!!
\(n_{Mg}=\dfrac{1,44}{24}=0,06\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{4,9}{98}=0,05\left(mol\right)\)
PTHH: \(Mg+H_2SO_4->MgSO_4+H_2\uparrow\)
Theo PTHH ta có tỉ lệ:
\(\dfrac{0,06}{1}>\dfrac{0,05}{1}=>\) a. Mg dư. \(H_2SO_4\) hết => tính theo \(n_{H2SO4}\)
Theo PT ta có: \(n_{Mg\left(pư\right)}=n_{H2SO4}=0,05\left(mol\right)\)
=> \(n_{Mg\left(dư\right)}=0,06-0,05=0,01\left(mol\right)\)
=> \(m_{Mg\left(dư\right)}==0,01.24=0,24\left(g\right)\)
b. Theo PT ta có: \(n_{H2SO4}=n_{MgSO4}=0,05\left(mol\right)\)
=> \(m_{MgSO_4}=0,05.120=6\left(g\right)\)

Bài 3 nè
\(n_{Al}=\frac{10,8}{27}=0,4\left(mol\right)\); \(n_{H_2SO_4}=\frac{49}{98}=0,5\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,4 0,5 (mol)
Xét tỉ lệ: \(\frac{0,4}{2}>\frac{0,5}{3}\)=> Al dư, H2SO4 hết
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
\(\frac{1}{3}\) <------ 0,5 ---------------------> 0,5 (mol)
=> \(n_{Al}dư=0,4-\frac{1}{3}=\frac{1}{15}\)(mol)
=> m Al dư = 27.\(\frac{1}{15}\)= 1,8 (mol)
\(V_{H_2}=0,5.22,4=11,2\left(l\right)\)

Số mol của H2SO4:
nH2SO4 = \(\frac{49}{98} = 0,5\) mol
Số mol của Al2O3:
nAl2O3 = \(\frac{60}{102} \approx 0,6\) mol
Pt: Al2O3 + 3H2SO4 --> Al2(SO4)3 + 3H2O
.....0,5 mol<--0,5 mol---> 0,5 mol
Xét tỉ lệ mol giữa H2SO4 và Al2O3:
\(\frac{0,5}{3} < \frac{0,6}{1}\)
Vậy Al2O3 dư
Khối lượng của muối nhôm sunfat được tạo thành:
mAl2(SO4)3 = 0,5 * 342 = 171 (g)
Khối lượng của Al2O3 dư sau pứ:
mAl2O3 dư = (0,6 - 0,5) * 102 = 10,2 (g)
Sửa: Al2O3 + 3H2SO4 --> Al2(SO4)3 + 2H2O
....0,17 mol.<--0,5 mol----> 0,17 mol
chỗ xét tỉ lệ mol pn ghi y chang, chỗ tính pn đổi số lại giùm mk, xin lỗi nhé

Phương trình hóa học của phản ứng:
So sánh tỉ lệ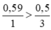 → Vậy Al2O3 dư
→ Vậy Al2O3 dư
mAl2O3 (dư) = 60 - 17 = 43(g)