

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



\(n_{KOH}=0,1.2=0,2mol\\ n_{MgSO_4}=0,1.0,8=0,08mol\\ n_{H_2SO_4}=0,1.0,4=0,04mol\)
Vì bazo và axit luôn pư trc nên H2SO4 hết MgSO4 dư.
\(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
0,08 0,04 0,04 0,08
\(2KOH+MgSO_4\rightarrow Mg\left(OH\right)_2+K_2SO_4\)
0,12 0,06 0,06 0,06
\(Mg\left(OH\right)_2\underrightarrow{t^0}MgO+H_2O\)
0,06 0,06 0,06
\(m_1=m_{Mg\left(OH\right)_2}=0,06.58=3,48g\\ m_2=m_{MgO}=0,06.40=2,4g\\ C_{M\left(K_2SO_4\right)}=\dfrac{0,04+0,06}{0,1+0,1}=0,5M\\ C_{M\left(MgSO_4\right)}=\dfrac{0,08-0,06}{0,1+0,1}=0,1M\)

a)X gồm Fe,Ag
\(Fe + 2AgNO_3 \to Fe(NO_3)_2 + Ag(1)\\ Fe + 2HCl \to FeCl_2 + H_2(2)\\ 2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O(3)\\ 2Ag + 2H_2SO_4 \to Ag_2SO_4 + SO_2 + 2H_2O(4)\\\)
b) Phần 1,gọi n\(n_{Ag} = a(mol)\)
Theo PTHH (2) : \(n_{Fe} = n_{H_2} = 0,1(mol)\)
Suy ra : m2 = 0,1.56 + 108a = 5,6 + 108a(gam)
Phần 2, \(n_{Ag} = ak(mol) ; n_{Fe} = 0,1k(mol)\)
Theo PTHH (3)(4) : \(n_{SO_2} = \)0,5.ak + 0,1k.1,5 = 0,5ak + 0,15k = 0,4
⇒ k(0,5a + 0,15) = 0,4(1)
m3 = 108.ak + 0,1k.56 (gam)
Ta có :
\(m_3 - m_2 = 16,4 \Rightarrow m_3 = 16,4 + m_2\)
⇔ k(108a + 5,6) = 16,4 + 5,6 + 108a = 22+ 108a(2)
Ta lấy (1) : (2), ta có :
\(\dfrac{0,5a + 0,15}{108a + 5,6} = \dfrac{0,4}{22 + 108a}\)⇒ a = 0,1
Vậy : k = \(\dfrac{0,4}{0,5a + 0,15} = 2\)
Vậy X gồm :
Fe : 0,1 + 0,1.2 = 0,3(mol)
Ag : 0,1 + 0,1.2 = 0,3(mol)
Fe + 2AgNO3 →Fe(NO3)2 + 2Ag
0,3.....0,3...............................0,3.........(mol)
Vậy :
m = (0,3 + 0,3).56 = 33,6 gam
V = \(\dfrac{0,3}{1}\) = 0,3(lít)
phần tính a bạn giải chi tiết dùm mình dc không, mình giải ko ra

Đặt: nCuO=x(mol); nCu=2x(mol) (x>0)
CuO + H2SO4(đ) -to-> CuSO4 + H2O
0,1__0,1___________0,1(mol)
Cu + 2 H2SO4 (đ) -to-> CuSO4 + SO2 + 2 H2O
0,2_____0,4______0,2_________0,2(mol)
V(SO2,đktc)=4,48(l) => nSO2=4,48/22,4=0,2(mol)
=> nCu=0,2(mol) => nCuO= 0,1(mol)
m1= 0,1. 80 + 0,2. 64= 20,8(g)
m2= (0,1+0,2).160=48(g)
=>m1+m2=20,8+48=68,8(g)
=>CHỌN C

Các PT:
\(2Na+2HCl\rightarrow2NaCl+H_2\)
\(Ca+2HCl\rightarrow CaCl_2+H_2\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\)
Từ tỉ lệ PT có: \(m_1:m_2=n_{H_2}:n_{H_2O}=\dfrac{6,72}{22,4}:\dfrac{21,6}{18}=\dfrac{1}{4}\)

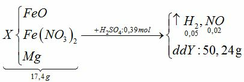
Vì Mg có tính khử rất mạnh nên trong Y có thể có muối (NH4)2SO4
BTNT N: 2nFe(NO3)2 = nNO + nNH4 => 2y = 0,02 + nNH4 => nNH4 = 2y – 0,02
BTNT H: 2nH2SO4 = 2nH2 + 4nNH4 + 2nH2O => 2 . 0,39 = 2 . 0,05 + 4 (2y – 0,02) + 2nH2O
=> nH2O = 0,38 – 4y
BTNT O: nFeO + 6nFe(NO3)2 = nNO + nH2O
=> x + 6y = 0,02 + 0,38 – 4y => x + 10y = 0,4
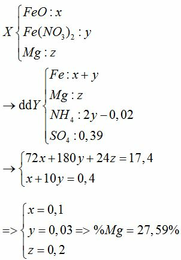

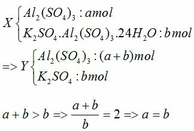
Vì dung dịch sau phản ứng chỉ chứa một chất tan => Z chỉ chứa KAlO2 hoặc K2SO4.
Khi cho từ từ Ba(OH)2 vào Y thì có thể xảy ra các phản ứng:
Al2(SO4)3 + 3Ba(OH)2 → 2Al(OH)3 + 3BaSO4(1)
2b → 6b 4b 6b (mol)
K2SO4 + Ba(OH)2 → 2KOH + BaSO4 (2)
b → b 2b b (mol)
Al(OH)3 + KOH → KAlO2 + 2H2O (3)
2b →2b 2b (mol)
· Trường hợp 1: Chất tan trong Z là K2SO4 → vừa đủ phản ứng (1)
Theo đề => a= b = 0,02 mol
nBaSO4 = nBa(OH)2 = 6b = 0,12mol
nAl(OH)3 = 4b = 0,08mol
m1= 948 . 0,02 + 342 . 0,02 = 25,8 gam
m2 = 0,08 . 78 + 0,12 . 233 = 34,2 gam
V = 0,12/2 = 0,06 lít = 60ml
· Trường hợp 2: Chất tan trong Z là KAlO2 →xảy ra cả (1,2,3)
nKAlO2 = 0,02mol
=> 2b = 0,02 => a = b =0,01
nBaSO4 = nBa(OH)2 = 7b = 0,07
nAl(OH)3 = 4b – 2b = 0,02
=> m1= 948.0,01 + 342.0,01 = 12,9 gam
m2 = 0,02.78 + 0,07.233 = 17,87 gam
V = 0,07/2 = 0,035 lít = 35ml