Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo bài ra ta có: p = e = 26
=> 2p = 52
Ta lại có: 2p - n = 22
⇔ n = 2p - 22
⇔ n = 52 - 22
⇔ n = 30
Mặt khác ta có: NTK(Fe) = p + n = 26 + 30 = 56
Vậy NTK(Fe) = 56 đvC

A)Ta có:
\(\left\{{}\begin{matrix}p+n+e=82\\n-p=4\end{matrix}\right.\)
mà \(p=e\) (trung hòa về điện)
\(\Rightarrow\left\{{}\begin{matrix}2p+n=82\\n-p=4\end{matrix}\right.\)
\(\Rightarrow p=e=26;n=30\)
\(M_X=26+30=56g/mol\)
\(\Rightarrow X\) là \(Fe\)
B) Giả sử có 1 mol Fe
\(V_{Fe}=\dfrac{8,74.10^{-24}.6,022.10^{23}}{74:100}=7,11cm^3\\D_{Fe}=\dfrac{1.56}{7,11} =7,88g/cm^3\)

a) \(2Z_A+N_A=60\Rightarrow N=60-2Z\)
Ta có : Z < N < 1,5Z
=> 3Z < 60 < 3,5Z
=> 17,14 < Z < 20
Mặt khác ta có : Z+N \(\le\) 40
TH1:ZA=18
=>NA=60−2.18=24
=> MA=18+24=42(Loại)
TH2:ZA=19
=>NA=60−2.19=22
=> MA=19+22=41(Loại)
TH3:ZA=20
=>NA=60−2.20=20
=> MA=20+20=40(Nhận)pA=20
⇒A:Canxi(Ca)
Trong nguyên tử B \(\left\{{}\begin{matrix}2Z_B+N_B=40\\N_B-Z_B=1\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}Z_B=13\\N_B=14\end{matrix}\right.\) => B là Al
b) Ca + 2H2O ⟶ Ca(OH)2 + H2
Al + Ca(OH)2 + H2O ⟶Ca(AlO2)2 + H2
Đặt x,y lần lượt là số mol Al, Ca(OH)2 phản ứng
=> \(\left\{{}\begin{matrix}40x+27y=9,4\\x+y=\dfrac{6,72}{22,4}=0,3\end{matrix}\right.\)
=> x= 0,1 ; y=0,2
=> \(m_{Ca}=0,1.40=4\left(g\right);m_{Al}=0,2.27=5,4\left(g\right)\)

Câu 2 :
n Fe = 2,8/56 = 0,05(mol)
Bảo toàn nguyên tố với Fe :
n Fe2O3 = 1/2 n Fe = 0,025(mol)
m Fe2O3 = 0,025.160 = 4(gam)

Điện tích hạt nhân là 19+
Số electron là 19e
Số e lớp ngoài cùng là 1e

Gọi công thức oxit sắt cần tìm là F e X O Y
Theo bài ta có: : = 7 : 3
Ta coi m F e = 7 gam; m O = 3 gam.
Khi đó:
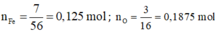
⇒ m C a O H 2 = 2.(40+17.2) = 148kg
⇒ n F e : n O = x : y = 0,125 : 0,1875 = 2 : 3
Vậy oxit sắt cần tìm là F e 2 O 3
⇒ Chọn A.

Chọn B
Tỉ lệ khối lượng giữa Fe và O là 7/3
=> Đặt khối lượng của Fe là 7 thì khối lượng của O là 3


Đáp án đúng: D
Cấu hình của X: \(1s^22s^22p^5\)
+ X có số hiệu nguyên tử là 9 → Điện tích hạt nhân là 9+ và có 9e.
+ X có 7e lớp ngoài cùng và e điền vào phân lớp cuối là phân lớp p → X thuộc nhóm VIIA (gần cuối chu kì) và X có 2 lớp e → X thuộc chu kì 2.
+ X thuộc nhóm VIIA (là nhóm phi kim mạnh)

30
\(A=\dfrac{9,2988.10^{-23}}{0,16605.10^{-23}}=56\left(đ.v.C\right)\\ N=A-P=A-Z^+=56-26=30\)
Vậy nguyên tử sắt có 30 neutron