Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì trong nguyên tử số hạt electron bằng số hạt proton nên trong R có số hạt proton, notron và electron lần lượt là Z, N và Z.
Theo giả thiết đề bài ta có:
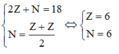
Khi đó cấu hình electron của R là 1s22s22p2.
Do đó số electron độc thân của R là 4.
Đáp án D

Đáp án D
Vì trong nguyên tử số hạt electron bằng số hạt proton nên trong R có số hạt proton, notron và electron lần lượt là Z, N và Z.
Theo giả thiết đề bài ta có: 2 Z + N = 18 N = Z + Z 2 ⇔ Z = 6 N = 6
Khi đó cấu hình electron của R là 1s22s22p2.
Do đó số electron độc thân của R là 4.

Cái nguyên tử X mình làm ko ra bạn xem lại đề cái 53,125 nếu là 53,125% thì bạn giải ra đươc p = 16 và n = 17 đó là lưu huỳnh ( ra nghiệm đẹp mình nghĩ là đúng )
Ta có 2p + n = 8 và n = 52,63/100 . ( p + n ) từ hệ trên bạn giải ra p = 9 và n = 10 đó là Flo

3. Khối lượng mol của hợp chất đó là :
2.28 = 56 (g/mol)
mC = \(\frac{56.85,7}{100}\approx48\left(g\right)\)
mH = 56 - 48 = 8 (g)
nC = \(\frac{48}{12}=4\left(mol\right)\)
nH = \(\frac{8}{1}=8\left(mol\right)\)
Vậy công thức hóa học là C4H8.

S : tổg , a: hiệu
Z = ( s + a ) / 4
= (46+14)/4 = 15
--> Y là : photpho (P)
Cấu hình e :
1s2 2s2 2p6 3s2 3p3
Ta có
p+e=2p
2p=<46 +14> :2=30
=> p=e=30 : 2 =15
=> n=46-30=16
=> p=e=35
n=16

\(\left\{{}\begin{matrix}P+E+N=18\\P=E\\N=\dfrac{1}{2}\left(P+E\right)\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2P+N=18\\P=E=N\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P=E=Z=6\\N=6\end{matrix}\right.\\ \Rightarrow A=Z+N=6+6=12\left(đ.v.C\right)\\ \Rightarrow KH:^{12}_6C\)

\(\left\{{}\begin{matrix}p+e+n=18\\n=\frac{\left(p+e\right)}{2}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2p+n=18\\n=\frac{2p}{2}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2p+n=18\\n=p\end{matrix}\right.\Leftrightarrow p=e=n=6\)
\(\rightarrow R:C\left(Cacbon\right)\)
Cấu hình: \(1s^22s^22p^2\)
Chọn B
tổng hạt: 2p + n = 18 (1)
Tổng số hạt không mang điện bằng trung bình cộng tổng số hạt mang điện:
\(\Leftrightarrow n=\frac{2p}{2}\Leftrightarrow2n-2p=0\left(2\right)\)
Từ (1) và (2) ta có hpt:
\(\Rightarrow\left\{{}\begin{matrix}2p+n=18\\2n-2p=0\end{matrix}\right.\) \(\Leftrightarrow p=e=n=6\)
Vì p = 6 nên cấu hình của nguyên tử R là:
\(1s^22s^22p^2\)
Vậy số electron độc thân của R là 2 ( chọn câu b )
( giải thích thêm: Vì \(2s^2\) đã bão hòa )
Đáp án B.
Tổng số các loại hạt proton, nơtron và electron của R là 18
p + n + e = 18 => 2p + n = 18 (1)
Số hạt không mang điện bằng trung bình cộng của tổng số hạt mang điện
n = (p+e)/2 hay n = p = e (2)
Từ (1), (2) ta có p = e = n =6
Cấu hình e của R : 1s2 2s2 2p2. Số electron độc thân = 2