Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4: Lớp ngoài cùng có 6e
X thuộc nhóm VIA
Hợp chất khí với Hidro của X là: H2X
X chiếm 94,12% khối lượng:
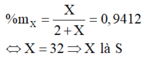
Công thức Oxit cao nhất là SO3
![]()

Đáp án D
Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4: Lớp ngoài cùng có 6e
⇒ X thuộc nhóm VIA
Hợp chất khí với Hidro của X là: H2X
X chiếm 94,12% khối lượng:
 X là S
X là S
Công thức Oxit cao nhất là 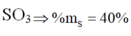

Chọn B
Công thức hợp chất khí là X H 2
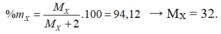
Vậy X là lưu huỳnh (S).
Công thức oxit cao nhất là S O 3
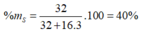

Đáp án D
X có cấu hình electron lớp ngoài cùng là ns2np4 → hợp chất khí của X với H là XH2
Trong XH2, X chiếm 94,12% về khối lượng nên ta có
![]() .100% = 94,12% → X= 32 → X là Lưu huỳnh
.100% = 94,12% → X= 32 → X là Lưu huỳnh
Oxit cao nhất của S là SO3 → %S = ![]() .100% = 40%
.100% = 40%

Đáp án D
Hướng dẫn X có cấu hình electron lớp ngoài cùng là ns2np4 → hợp chất khí của X với H là XH2
Trong XH2, X chiếm 94,12% về khối lượng nên ta có
![]() → X= 32 → X là Lưu huỳnh
→ X= 32 → X là Lưu huỳnh
Oxit cao nhất của S là SO3 → ![]()

Đáp án D
X: ns2np4 → X thuộc nhóm IVA → hợp chất khí với H là XH2 → oxit cao nhất là XO3
Ta có: ![]() → MX = 32 (đvC)
→ MX = 32 (đvC)
→ %X trong oxit cao nhất = ![]() .100% = 40%
.100% = 40%

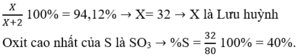

a)%H=100-82,35=17,65g
vì số e lớp ngài cùng là 5 và R thuộc họ p nên R thuộc nhóm VA
-> công thức của R với hidro là RH3
vì hidro chiếm 17, 65% khối lượng-> R chiếm 82,35%
-> MR=0,8235.(MR+3)
-> MR=13,997(g)
-> R là Nitơ (N)
công thức oxit cao nhất của R là N2O5
công thức hidroxit của R là HNO3