Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

HCl 1 : Vdd(1) = mdd/D => mdd= Vdd. D
=> mHCl = (mdd . C%)/100 => số mol HCl
HCl 2 : số mol HCl 2 = CM. Vdd(2)
=> số mol tổng , Vtổng =Vdd1 + Vdd2
=> CM
bài này bạn xem lại dữ liệu khối lượng riêng nhé

Gọi CM H2SO4 = a là M. CMNaOH = b là M
- Nếu đổ 3 lít dung dịch NaOH vào 2 lít dung dịch H2SO4 thì khau khi phản ứng dung dịch có tính kiềm với nồng độ 0,1M
=> 3.b - 2.2a = 0,1.(2+3) =0,5
- Nếu đổ 2 lít dung dịch NaOH vào 3 lít dung dịch H2SO4 thì khau khi phản ứng dung dịch có tính axit với nồng độ 0,2M
=> 3.2.a-2b = 5.0,2 = 1
=> a=0,4
b = 0,7
Cảm ơn vì bạn đã trả lời câu hỏi của mình!nhưng bạn có thể giải thích cho mình tại sao3.b-2.2a=0,1.(2+3)=0,5 và 3.2.a-2b=5.0,2=1 ![]()

\(a.BT\left[Cl\right]:n_{AgCl}=n_{HCl\left(X\right)}=\dfrac{35,875}{143,5}=0,25mol\\ HCl+NaOH->NaCl+H_2O\\ n_{HCl\left(Y\right)}=0,5.0,3=0,15mol\\ C_{M\left(Z\right)}=\dfrac{0,4}{2}=0,2\left(M\right)\\ b.Fe+2HCl->FeCl_2+H_2\\ n_{HCl\left(X\right)}=a;n_{HCl\left(Y\right)}=b\left(mol\right)\\ a-b=\dfrac{0,448}{22,4}.2=0,04mol\\ Từ\left(a\right)\Rightarrow n_{HCl\left(X\right)}:n_{HCl\left(Y\right)}=0,25:0,15=\dfrac{5}{3}=\dfrac{a}{b}\\ \Rightarrow a=0,1;b=0,06\\ C_{M\left(X\right)}=\dfrac{0,1}{0,1}=1M\\ C_{M\left(Y\right)}=\dfrac{0,06}{0,1}=0,6\left(M\right)\)

\(n_{HCl}=0,3.1=0,3\left(mol\right)\\ NaOH+HCl\rightarrow NaCl+H_2O\\ n_{NaOH}=n_{NaCl}=n_{HCl}=0,3\left(mol\right)\\ V_{\text{dd}NaOH}=V=\dfrac{0,3}{2}=0,15\left(l\right)\\ C_{M\text{dd}A}=C_{M\text{dd}NaCl}=\dfrac{0,3}{0,15+0,3}=\dfrac{2}{3}\left(M\right)\)

bạn vô trang hóa này đi sẽ có nhiều người giúp bạn https://www.facebook.com/groups/1515719195121273/

1)\(n_{NaOH}:\dfrac{60.10\%}{100\%.40}=0,15\left(mol\right)\)
KL dung dịch sau p/ư: 60+40=100(g)
\(n_{NaCl}:\dfrac{100.5,85\%}{100\%.58,5}=0,1\left(mol\right)\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
1...................1...............1.................(mol)
0,1................0,1............0,1...............(mol)
-> NaOH dư
C% dd HCl: \(\dfrac{0,1.36,5}{40}.100\%=9,125\%\)

a) Phương trình hóa học của phản ứng:
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 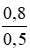
CM (NaOH)dư = 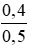
tích cho mình nha![]()

a)
$n_{MgO} = \dfrac{8}{40} = 0,2(mol)$
$MgO + 2HCl \to MgCl_2 + H_2O$
$n_{HCl} = 2n_{MgO} = 0,4(mol) \Rightarrow V_{dd\ HCl} = \dfrac{0,4}{1} = 0,4(lít)$
b)
$n_{MgCl_2} = n_{MgO} = 0,2(mol) \Rightarrow C_{M_{MgCl_2}} = \dfrac{0,2}{0,4} = 0,5M$
c)
$MgCl_2 + 2NaOH \to Mg(OH)_2 + 2NaCl$
$n_{NaOH} = 2n_{MgCl_2} = 0,4(mol)$
$n_{Mg(OH)_2} = n_{MgCl_2} = 0,2(mol)$
Suy ra :
$V = \dfrac{0,4}{1} = 0,4(lít)$
$m_{Mg(OH)_2} = 0,2.58 = 11,6(gam)$
\(n_{MgO}=\dfrac{8}{40}=0,2mol\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
0,2 0,4 0,2 0,2
a)\(V_{HCl}=\dfrac{0,4}{1}=0,4\left(l\right)=400ml\)
c) \(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\)
0,2 0,2
\(\Rightarrow V_{NaOH}=\dfrac{0,2}{1}=0,2\left(l\right)=200ml\)
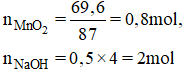
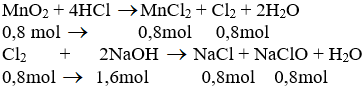

Gọi nồng độ dung dịch HCl, NaOH lần lượt là x, y
TN1:
\(\text{nHCl = 0,15x mol}\)
\(\text{nNaOH = 0,1y mol}\)
\(\text{HCl + NaOH → NaCl + H2O}\)
Dung dịch sau phản ứng có tính kiềm nên NaOH còn dư
Thể tích dung dịch sau phản ứng: 150 + 100 = 250ml
nNaOH dư = 0,1 . 0,25 = 0,025 mol
nNaOH p.ư = nHCl = 0,15x
→ nNaOH dư = 0,1y - 0,15x = 0,025 (1)
TN2:
\(\text{nHCl = 0,35x mol}\)
\(\text{nNaOH = 0,15y mol}\)
\(\text{HCl + NaOH → NaCl + H2O}\)
Dung dịch sau phản ứng có tính axit nên HCl còn dư
Thể tích dung dịch sau phản ứng: 350 + 150 = 500ml
nHCl dư = 0,05 . 0,5 = 0,025 mol
nHCl p.ư = nNaOH = 0,15y
→ nNaOH dư = 0,35x - 0,15y = 0,025 (2)
Từ (1) và (2) → x = 0,5; y = 1