Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`Fe + 2HCl -> FeCl_2 + H_2 \uparrow`
`0,1` `0,2` `0,1` `0,1` `(mol)`
`n_[Fe]=[5,6]/56=0,1(mol)`
`a)V_[H_2]=0,1.22,4=2,24(l)`
`b)C_[M_[HCl]]=[0,2]/[0,1]=2(M)`

giả sử 2 kim loại cùng 1 khối lượng là a , ta có
\(2Al+6HCl->2AlCl_3+3H_2\)
(mol) \(\frac{a}{27}\) \(\frac{a}{18}\)
\(Fe+2HCl->FeCl_2+H_2\)
(mol) \(\frac{a}{56}\) \(\frac{a}{56}\)
vì \(\frac{a}{56}< \frac{a}{18}\) => cùng 1 khối lượng như nhau , Al cho thể tích khí hidro nhiều hơn Fe

Phương trình hóa học của phản ứng:
Fe + H2SO4 → FeSO4 + H2.
Zn + H2SO4 → ZnSO4 + H2.
Fe + 2HCl → FeCl2 + H2.
Zn + 2HCl → ZnCl2 + H2.
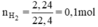
Theo phương trình (3) mFe cần dùng: 56.0,1 = 5,6g.
Theo phương trình (4) mZn cần dùng: 65.0,1 = 6,5g.

![]()
Để điều chế 0,05 mol H 2 thì:
n Z n = n M g = 0,05 mol mà M M g < M Z n
⇒ Dùng Mg sẽ cần khối lượng nhỏ hơn
n H C l = 2 . n H 2 = 0,05 . 2 = 0,1 mol ⇒ m H C l = 0,1 . 36,5 = 3,65 g
n H 2 S O 4 = n H 2 = 0,05 mol ⇒ m H 2 S O 4 = 0,05 .98 = 4,9g
⇒ Dùng axit HCl sẽ cần khối lượng nhỏ hơn
Nên với những chất đã cho muốn dùng với khối lượng nhỏ nhất để điều chế H 2 ta dùng Mg và axit HCl

a. Phương trình hóa học có thể điều chế hiđro.
Zn + 2HCl → ZnCl2 + H2
Fe + H2SO4 (loãng) → FeSO4 + H2
Zn + H2SO4 → ZnSO4 + H2
Fe + 2HCl → FeCl2 + H2
b. Số mol khí hiđro là: n = 0,1 (mol)
Khối lượng kẽm cần dùng là: m = 0,1x65 = 6,5 (g)
Khối lượng sắt cần dùng là: m = 0,1x56 = 5,6 (g).
Phan Thùy Linh tại sao lại số mol của H2 bằng 0,1 (vậy số liệu 2,24 l đang ở đâu, làm sao có kết quả này).
Khi viết m, viết n em có biết khối lượng của cái gì hay là số mol của cái gì đâu. dù đã dẫn ở lời giải nhưng vẫn phải viết chứ.
Đối với những phản ứng điều chế khí thì khí thường bay hơi nên phải có chiều mũi tên đi lên nhé.
Đối với phản ứng số (3) thì Zn chỉ phản ứng được với "H2SO4 (loãng)" thôi.

a) \(n_{Fe}=\dfrac{28}{56}=0,5\left(mol\right);n_{Zn}=\dfrac{32,5}{65}=0,5\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,5 1 0,5
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,5 1 0,5
\(V_{H_2}=\left(0,5+0,5\right).22,4=22,4\left(l\right)\)
b, \(m_{HCl}=\left(1+1\right).36,5=73\left(g\right)\)

nFe = 0.5 (mol)
nZn = 0.5 (mol)
Fe + 2HCl → FeCl2 + H2↑
0.5 1 0.5
Zn + 2HCl → ZnCl2 + H2↑
0.5 1 0.5
=> Tổng nH2 = 1 (mol) => VH2 = 22.4x1=22.4 (l)
b) Tổng nHCl = 2 (mol) => mHCl = 2x36.5=73 (g)
Chọn A.