Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích: Đáp án C
nCu2+ = nCu(NO3)2 = 0,2 mol
Fe + Cu2+ -> Fe2+ + Cu
1 mol Fe phản ứng tạo 1 mol Cu => mtăng = 64 – 56 = 8g
=> nFe pứ = (101,2 – 100)/8 = 0,15 mol
=> mFe pứ = 8,4g

Đáp án B
Có khối lượng chất rắn sau khi nung < mX
=> Chứng tỏ X phản ứng còn dư, Cu(NO3)2 phản ứng hết.
· Trường hợp 1: Mg phản ứng còn dư.
Áp dụng tăng giảm khối lượng có:
nMg phản ứng 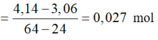
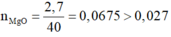 => Vô lý
=> Vô lý
· Trường hợp 2: Fe đã tham gia phản ứng.
Đặt số mol Mg và Fe phản ứng lần lượt là a, b.
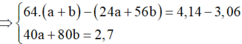
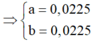
![]()
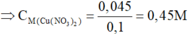

Đáp án D
Vì dung dịch C đã mất màu hoàn toàn nên cả Ag+ và Cu2+ đều phản ứng hết.
Mà B không tan trong HCl nên B chỉ chứa Ag và Cu. Do đó cả Al và Fe đều phản ứng hết.
Suy ra cho X vào A thì cả 4 chất đều phản ứng vừa đủ.
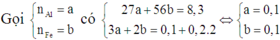
Vì dung dịch E đã nhạt màu nên Ag+ đã phản ứng hết và Cu2+ đã phản ứng một phần.
Do đó D chứa Ag và Cu.
Dung dịch E chứa Al3+, Fe2+ và Cu2+ dư. Khi đó E chứa Fe(OH)2 và Cu(OH)2
Suy ra F chứa Fe2O3 và CuO
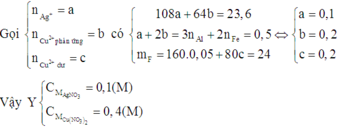

Câu 1 :
\(n_{FeCl_3} = \dfrac{28,275}{162,5}=0,174(mol)\\ \)
Fe + 2FeCl3 → 3FeCl2
0,087.......0,174.......0,261...............(mol)
Vậy :
m = 0,087.56 + 11,928 = 16,8(gam)
mmuối = 0,261.127 = 33,147(gam)
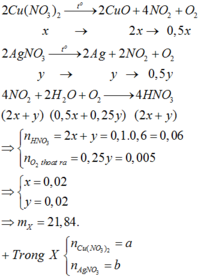
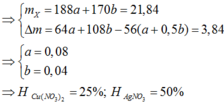

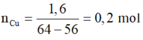
Có phải A không ạ?
A