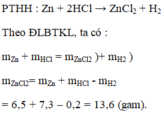Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Zn\left(pứ\right)}=1,3-0,65=0,65g\)
\(n_{Zn}=\dfrac{0,65}{65}=0,01mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,01 0,02 0,01 0,01 ( mol )
\(V_{H_2}=0,01.24=0,24l\)
\(m_{HCl}=\dfrac{0,02.36,5}{7,3\%}=10g\)
\(m_{ZnCl_2}=0,01.136=1,36g\)
\(m_{ddspứ}=1,3+10-0,01.2=11,28g\)
\(C\%_{ZnCl_2}=\dfrac{1,36}{11,28}.100=12,05\%\)

a/ PTHH: Zn + 2HCl ===> ZnCl2 + H2
b/ Công thức về khối lượng:
mZn + mHCl = mZnCl2 + mH2
Ta thấy mdung dịch tăng = mZn - mH2 = 63
=> mH2 = mZn - 63 = 65 - 63 = 2 gam
Áp dụng định luật bảo toàn khối lượng
=> mZnCl2 = mZn + mHCl - mH2 = 65 + 73 - 2 = 136 gam

\(PTHH:Zn+2HCl->ZnCl_2+H_2\)
ap dung DLBTKL ta co
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(=>m_{H_2}=m_{Zn}+m_{HCl}-m_{ZnCl_2}\\ =>m_{H_2}=13+14,6-27,2\\ =>m_{H_2}=0,4\left(g\right)\)

a, \(m_{HCl}=150.14,6\%=21,9\left(g\right)\Rightarrow n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Theo PT: \(n_{Zn}=n_{ZnCl_2}=n_{H_2}=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,3.65=19,5\left(g\right)\)
b, \(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
c, Ta có: m dd sau pư = 19,5 + 150 - 0,3.2 = 168,9 (g)
\(\Rightarrow C\%_{ZnCl_2}=\dfrac{0,3.136}{168,9}.100\%\approx24,16\%\)

mZn giảm 6,5 g=>có 6,5 g Zn đã p/ứ
nZn=6,5/65=0,1(mol)
pt: 2HCl+Zn--->ZnCl2+H2
0,2______0,1____0,1____0,1
VH2=0,1.22,4=2,24(l)
mHCl=0,2.36,5=7,3(g)
dd chứa ZnCl2
mZnCl2=0,1.136=13,6(g)

a) Khi ngâm lá sắt vào dung dịch X thì không thấy khí thoát ra nên Cuo và H2SO4 phản ứng vừa đủ với nhau .
\(CuO+H_{2^{ }_{ }}SO_{4_{ }}\rightarrow CuSO_{4_{ }}+H_2O\left(1\right)\)
Khi dung dịch X không còn màu xanh thì CuSO4 đã phản ứng hết
\(CuSO_4+Fe\rightarrow FeSO_{4_{ }}+Cu\left(2\right)\)
Theo phản ứng (1) và (2)
\(n_{Cuo}=n_{H_2SO_4}=n_{CuSO_4}=n_{Cu}=\frac{2}{64-56}=0,25\left(mol\right)\)
Nồng độ phần trăm của dung dịch H2SO4
\(C\%_{H_2SO_4}=\frac{0,25.98}{122,5}.100\%=20\%\Rightarrow C=20\)
b) Khối lượng của dung dịch sau phản ứng:
\(m_{dd}=m_{CuO}+m_{ddH_2SO_4}-\left(m_{Cu}-m_{Fe}\right)=20+122,5-2=140,5\left(g\right)\)
Theo phản ứng (2) :
\(n_{FeSO_4}=n_{Cu}=0,25\left(mol\right)\Rightarrow m_{FeSO_4}=0,25.152=38\left(g\right)\)
Nồng độ phần trăm của dung dịch sau khi lấy sắt ra là:
\(C\%_{FeSO_4}=\frac{38}{140,5}.100\%=27,05\%\)

Gọi \(n_{Zn\left(pư\right)}=a\left(mol\right)\)
PTHH: Zn + CuCl2 ---> Cu + ZnCl2
a a a
mgiảm = mZn (tan ra) - mCu (bám vào) = 65a - 64a = 0,0075
=> a = 0,0075 (mol)
=> mZn (pư) = 0,0075.65 = 0,4875 (g)
\(C_{MCuCl_2}=\dfrac{0,0075}{0,02}=0,375M\)
C% thì thiếu dCuCl2 nha
Gợi ý: \(C\%=C_M.\dfrac{M}{10.D}\left(D:\dfrac{g}{cm^3}hay\dfrac{g}{ml}\right)\)
Gọi \(n_{Zn}=x\left(mol\right)\Rightarrow n_{Cu}=x\left(mol\right)\)
Khối lượng giảm 0,0075g.
\(\Rightarrow m_{Zn}-m_{Cu}=0,0075\Rightarrow65x-64x=0,0075g\)
\(\Rightarrow x=0,0075\)
\(Zn+CuCl_2\underrightarrow{t^o}ZnCl_2+Cu\)
0,0075 0,0075
\(m_{Zn}=0,0075\cdot65=0,4875g\)
\(C_{M_{CuCl_2}}=\dfrac{0,0075}{0,02}=0,375M\)