Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt nZn = x mol; nFe = y mol.
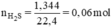
Ta có hệ phương trình: 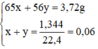
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Bài 1:
a+b) PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)=n_{Fe}\)
\(\Rightarrow m_{Fe}=0,2\cdot56=11,2\left(g\right)\) \(\Rightarrow m_{Cu}=6,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{11,2}{17,6}\cdot100\%\approx63,64\%\\\%m_{Cu}=36,36\%\end{matrix}\right.\)
c) Ta có: \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
Bảo toàn nguyên tố: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)=n_{CuSO_4}\)
\(\Rightarrow m_{muối}=0,1\cdot400+0,1\cdot160=56\left(g\right)\)
Bài 2:
Quy đổi hh gồm Fe (a mol) và O (b mol)
\(\Rightarrow56a+16b=27,6\) (1)
Ta có: \(n_{SO_2}=\dfrac{5,04}{22,4}=0,225\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}=2n_O+2n_{SO_2}\) \(\Rightarrow3a-2b=0,45\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,39\\b=0,36\end{matrix}\right.\)
Bảo toàn nguyên tố: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,195\left(mol\right)\) \(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,195\cdot400=78\left(g\right)\)

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ Đặt:n_{Fe}=a\left(mol\right);n_{Zn}=b\left(mol\right)\left(a,b>0\right)\\ \Rightarrow\left\{{}\begin{matrix}56a+65b=23,3\\a+b=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,1\end{matrix}\right.\\ \Rightarrow\%m_{Zn}=\dfrac{0,1.65}{23,3}.100\approx27,897\%\\ \Rightarrow\%m_{Fe}\approx72,103\%\)
Fe+2HCl--->FeCl2+H2
Zn+2HCl-->ZnCl2+H2
Gọi số mol của Fe và Zn lần lượt là x,y mol
=> ta có hpt {56x+65y=23,3
{x+y=8,96/22,4
<=>{x=0,3=>mFe=16,8g
{y=0,1=>mZn=6,5g
nHCl=2nH2=2.8,96/22,4=0,8 mol
=>mHCl=29,2g
%mFe=16,8/23,3.100=72,10300429%
=>%mZn=27,89699571%
Chúc bn học giỏi

Gọi nZn = x , nCu = y (mol)
=> 65x+64y = 12,9 (1)
nkhí = \(\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
dk/H2 = 19 => Mkhí = 38
NO 30 8 1
38
NO2 46 8 1
=> \(\dfrac{nNO}{nNO_2}=1:1\)
=> nNO = 0,1(mol) , nNO2 = 0,1 (mol)
Zn => Zn+2 + 2e x 2x | N+5 + 3e => N+2 0,3 0,1 |
Cu => Cu+2 + 2e y 2y | N+5 + 1e => N+4 0,1 0,1 |
=> 2x + 2y = 0,4 (mol) (2)
Từ 1 + 2 => x = 0,1, y = 0,1 (mol)
=> mCu = 6,4g
mZn = 6,5g

Theo đề bài ta có bột S dư nên Fe, Zn tác dụng hết với S.
a)Phương trình hóa học của phản ứng.
Zn + S -> ZnS Fe + S -> FeS
x mol x mol y mol y mol
ZnSO4 + H2SO4 -> ZnSO4 + H2S
x mol x mol
FeSO4 + H2SO4 -> FeSO4 + H2S
x mol y mol
Ta có hệ phương trình :
Giải hệ phương trình => x = 0,04 (mol), y = 0,02 (mol).
Vậy mZn = 0,04.65 = 2,6g
mFe = 0,02.56 = 1,12g.

Bài 3 :
a) $Mg + H_2SO_4 \to MgSO_4 + H_2$
$n_{Mg} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$\%m_{Mg} = \dfrac{0,15.24}{13,2}.100\% = 27,27\%$
$\%m_{Cu} = 100\% -27,27\% = 72,73\%$
b) $n_{Cu} = \dfrac{13,2 - 0,15.24}{64}= 0,15(mol)$
$\Rightarrow m_{muối} = 0,15.120 + 0,15.160= 42(gam)$
Bài 4 :
Gọi $n_{Fe} = a(mol) ; n_{Mg} = b(mol)$
$56a + 24b = 18,4(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
Theo PTHH : $n_{H_2} = a + b = \dfrac{11,2}{22,4} = 0,5(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,3
$\%m_{Fe} = \dfrac{0,2.56}{18,4}.100\% = 60,87\%$
$\%m_{Mg} = 100\% -60,87\% = 39,13\%$
b) $n_{HCl} = 2n_{H_2} = 1(mol)$
$V_{dd\ HCl} = \dfrac{1}{0,8}= 1,25(lít)$




n\(_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 (mol)
\(\rightarrow m_{Zn}=0,2.65=13\left(g\right)\)
\(\Rightarrow m_{Cu,Ag}=45,5-13=32,5\left(g\right)\)
đặt số mol của Cu là a;Ag là b,ta có:
64a+108b=32,5(1)
\(Zn+\dfrac{1}{2}O_2\rightarrow ZnO\)
0,2 0,2 (mol)
\(\rightarrow m_{ZnO}=0,2.81=16,2\left(g\right)\)
\(\rightarrow m_{CuO,Ag_2O}=\)51,9-16,2=35,7(g)
\(Cu+\dfrac{1}{2}O_2\rightarrow CuO\)
a a (mol)
\(2Ag+\dfrac{1}{2}O_2\rightarrow Ag_2O\)
b \(\dfrac{1}{2}b\) (mol)
ta có:\(80a+116b=35,7\)(2)
từ (1) và (2) ta có hệ:
\(\Leftrightarrow\left\{{}\begin{matrix}64a+108b=32,5\\80a+116b=35,7\end{matrix}\right.\)\(\Leftrightarrow\left\{{}\begin{matrix}a=\dfrac{107}{1520}\\b=\dfrac{197}{760}\end{matrix}\right.\)
\(\rightarrow m_{Cu}=\dfrac{107}{1520}.64\approx4,5\left(g\right)\)
\(m_{Ag}=\dfrac{197}{760}.108\approx28\left(g\right)\)