Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) (-) Nhôm và oxi Lấy bột nhôm bỏ vào 1 miếng bìa cứng . Khum tờ giấy chứa bột nhôm , rắc nhẹ bột nhôm trên ngọn lửa đèn cồn .
Hiện tượng: Có những hạt loé sáng do bột nhôm tác dụng với oxi, phản ứng toả nhiều nhiệt.
Chất tạo thành màu trắng sáng là nhôm oxit Al2O3
Giải thích: Vì xảy ra phản ứng nhôm tác dụng với oxi trong không khí.
(-) Sắt và lưa huỳnh Trộn bột sắt và bột lưa huỳnh rồi cho vào ống nghiệm ,Hơ ống nghiệm trên đèn cồn .
Hiện tượng: Khi đun hỗn hợp trên ngọn lửa đèn cồn, sắt tác dụng mạnh với lưu huỳnh hỗn hợp cháy nóng đỏ, phản ứng toả nhiều nhiệt.
Chất tạo thành có màu đen (không bị nam châm hút).
Giải thích: Vì xảy ra phản ứng sắt tác dụng với lưu huỳnh.
b) PTHH : 4Al + 3O2 → Al2O3→ Trong PƯHH nhôm đóng vai trò là chất khử.
PTHH : Fe + S → → FeS Hỗn hợp sắt và lưu huỳnh trước phản ứng có màu xám.
a)
(+) Nhôm và oxi
Lấy bột nhôm bỏ vào 1 miếng bìa cứng . Khum tờ giấy chứa bột nhôm , rắc nhẹ bột nhôm trên ngọn lửa đèn cồn .
(+) Sắt và lưa huỳnh
Trộn bột sắt và bột lưa huỳnh rồi cho vào ống nghiệm ,Hơ ống nghiệm trên đèn cồn .
b)
PTHH :
4Al + 3O2 \(\rightarrow\) 2Al2O3
PTHH :
Fe + S \(\rightarrow\) FeS
P/s : Em ms lp 8 nên ko bt đúng hay sai

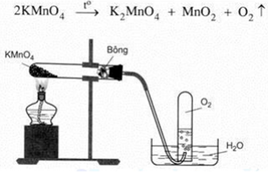
– Dùng phương pháp đẩy nước là hợp lí vì oxi ít tan trong nước và oxi thu được có độ tinh khiết cao.
– Oxi nặng hơn không khí, khi đốt nóng KMnO4 thì áp suất tại đó cao hơn nên
– Oxi sinh ra sẽ di chuyển xuống phía dưới ống nơi áp suất thấp hơn và dễ dàng thoát ra ống dẫn khí. – Bông khô có vai trò hút ẩm.
– Khi dừng thí nghiệm nên tắt đèn cồn trước sau đó mới tháo ống dẫn khí.

a, Chất rắn màu xám sẫm Kẽm (Zn) tan dần và xuất hiện bọt khí do khí Hidro (H2) tạo thành.
b, Cháy sáng trong không khí với ngọn lửa sáng chói, tỏa nhiều nhiệt, tạo ra Al2O3 .
c, Mẫu Na chuyển động nhanh trên mặt nước , tan dần cho đến hết, có khí H2 bay ra, phản ứng toả nhiều nhiệt đồng thời dung dịch chuyển sang màu hồng .

Hiện tượng thí nghiệm: Al4C3 tan dần, có hiện tượng sủi bọt khí, xuất hiện kết tủa keo trắng.
Al4C3 + 12H2O → 4Al(OH)3 ↓ + 3CH4 ↑

mình chỉ góp ý về câu 4.1
Trên lý thuyết: khi cho Al vào dd CuSO4 thì Al sẽ đấy Cu ra khỏi muối tạo lớp Cu màu đỏ bám vào thanh Al, dd mất dần màu xanh
Nhưng, trên thực tế, khi cho Al vào dd CuSO4 thì ngoài các hiện tượng nêu trên (lý thuyết) thì dd còn có khí thoát ra nhiều và liên tục (H2)
thực ra thì không chỉ Al mà còn còn có Fe, Zn tác dụng với dd CuSO4, dd (CH3COO)2Cu tạo khí H2. Và lượng khí này thoát ra rất nhiều chứ không phải là ít, tới khi kết thúc pứ Cái này mình đã làm thí nghiệm nhiều lần và nó là hiện tượng thuộc dạng khó hiểu, đã tìm hiểu nhiều, hỏi mọi nơi mà không có kết quả. Nhưng gần đây mình nghĩ đó là hiện tượng pứ thứ cấp do tạo thành cặp pin điện hóa khi Cu tác dụng với kim loại Al thì Cu sẽ bám vào Al tạo thành cặp pin điện hóa Al - Cu với chất điện li là muối tan có sẵn. Cặp pin này pứ với H2O để tạo ra H2. Vấn đề này chỉ có thể giải thích bằng pin điện hóa chứ không thể bằng cách khác, vì bình thường Fe cũng không thể tác dụng với H2O mà sinh H2 không thể do dung dịch CuSO4 có tính axit vì (CH3COO)2Cu cũng có xảy ra hiện tượng với cường độ tương tự nhưng cơ chế thì đến bây giờ vẫn pó tay. =((
4.1: màu xanh của dd nhạt dần, có chất rắn màu nâu đỏ bám ngoài thanh nhôm. Phương trình: Al + CuSO4 ( xanh lam ) ---> Al2(SO4)3 + Cu ( nâu đỏ )
4.2: do dd H2SO4 đặc có tính oxi hóa .mạnh , axit đặc có tính háo nước, do vậy có thể ghi pứ như sau:
C12H22O11 - - H2SO4 đăc- - - > 6C + 6H2O
C + 2H2SO4 đặc - - > CO2↑ + 2H2O + 2SO2↑

1) Mẫu kẽm tan dần đến hết và có khí không màu sinh ra là H2H2
Zn+2HCl→ZnCl2+H2Zn+2HCl→ZnCl2+H2
2) Mẫu nhôm không tan do AlAl bị thụ động trong H2SO4H2SO4 đặc, nguội.
3) Dây nhôm tan dần, phản ứng xảy ra mãnh liệt tỏa nhiệt và có khí không màu sinh ra.
2Na+2Al+3H2O→2NaAlO2+3H22Na+2Al+3H2O→2NaAlO2+3H2
4)
Xuất hiện kết tủa trắng tan dần tới cực đại.
BaCl2+H2SO4→BaSO4+2HCl
CÒN LẠI ĐANG NGHĨ
từ 1-> 4 có người làm rồi nên mk làm từ 5->9 nha
5. Cho từ từ dd BaCl2 vào ống nghiệm chứa Na2CO3 thấy có kết tủa trắng xuất hiện
BaCl2 + Na2CO3 --> BaCO3 + 2NaCl
6. Cho từ từ dd HCl vào ống nghiệm chứa dd NaOH có để sẵn giấy quỳ tím, hiện tượng giấy quỳ từ xanh (do đặt trong môi trường kiềm) chuyển thành màu đỏ khi dư HCl
HCl + NaOH ---> NaCl + H2O
7. Cho đinh sắt vào ống nhgiệm chứa dd CuSO4 thấy có kết tủa Cu đỏ bám trên đinh sắt
Fe + CuSO4 --> FeSO4 + Cu
8. Cho NaOH vào ống nghiệm chứa dd CuSO4 sau đó lọc chất lấy kết tủa rồi đun nhẹ: kết tủa sau lọc có màu xanh ( Cu(OH)2, đun nhẹ thấy màu đen xuất hiện (CuO)
2NaOH + CuSO4 --> Cu(OH)2 + Na2SO4
Cu(OH)2 --> CuO + H2O
9 Cho từ từ AgNO3 vào ống nghiệm chứa dd NaCl thấy có kết tủa trắng xuất hiện
AgNO3 + NaCl --> AgCl + NaNO3

a) PTHH : \(Fe+CuSO_4-->FeSO_4+Cu\)
Hiện tượng : - Đinh sắt tan dần trong dd muối đồng
- dd muối đồng từ màu xanh lam nhạt dần rồi mất màu
- xuất hiện chất rắn có màu nâu đỏ
b) PTHH : \(Al+H_2SO_{4\left(dac.nguoi\right)}-->\) Không phản ứng
Hiện tượng : Không hiện tượng

a) Có kết tủa trắng xuất hiện:
BaCl2+H2SO4\(\rightarrow\)BaSO4\(\downarrow\)+2HCl
b) Al cháy sáng trên ngọn lửa đèn cồn:
4Al+3O2\(\overset{t^0}{\rightarrow}\)2Al2O3
Hiện tượng: Bột nhôm cháy phát ra những tia sáng trắng.
Phương trình hóa học: 4 A l + 3 O 2 → 2 A l 2 O 3
Vai trò của nhôm: Al là chất khử