Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : C
X + HCl : Fe -> Fe2+ có nH2 = 0,055 mol
X + Cl2 : Fe -> Fe3+
bảo toàn e : 5nKMnO4 = 2nCl2 => nCl2 = 0,06 mol
Do M có hóa trị không đổi => nFe = ne (2) – ne (1) = 2nCl2 – 2nH2 = 0,01 mol
Giả sử M có hóa trị n => n.nM + 2.0,01 = 2nH2 => n.nM = 0,09 mol
Có : mX = 1,37g = 0,01.56 + nM.M => nM.M = 0,81g
=> M = 9n
Nếu n = 3 => M = 27g (Al) Thỏa mãn

Chọn đáp án A
Chú ý tỉ lệ dung dich X trong mỗi phản ứng
Gọi số mol ion Na+, NH4+, CO32- và SO42- trong 100ml lần lượt a, b, c, d mol
Khi cho X tác dụng với HCl chỉ có CO32- tham gia phản ứng → c = 0,1 mol
Khi cho X tác dụng với BaCl2 thu được BaCO3 và BaSO4 → 0,1.197 + d.233= 43 → d = 0,1 mol
Khi cho X tác dụng lượng dư dung dịch NaOH chỉ có NH4+ tham gia phản ứng → b = 0,2 mol
Bảo toàn điện tích trong dung dịch X → a = 2. 0,1 + 2. 0,1 -0,2 = 0,2 mol
Vậy trong 300ml dung dịch X gồm 0,6 mol Na+, 0,6 mol NH4+, 0,3 mol CO32- và 0,3 mol SO42-
→ m = 0,6.23 + 0,6. 18 + 0,3. 60 + 0,3. 96= 71,4 gam.
Đáp án A.

Chọn đáp án A
Xét thí nghiệm 2: chú ý tính thụ động hóa của kim loại:
H2SO4 đặc, nguội không phản ứng với Al, Cr, Fe!
⇒ trong X chỉ có Cu phran ứng. Bảo toàn electron: n C u = n S O 2 = 0 , 075 m o l
Đặt nCr = x mol; nFe = y mol ⇒ m X = 52x + 56y + 0,075 × 64 = 18,2 gam.
nH2 = x + y = 0,25 mol. Giải hệ có: x = 0,15 mol; y = 0,1 mol.
⇒ % mCr trong X = 42,86% và %mCu trong X = 26,37%

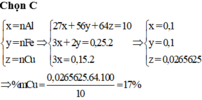




Đáp án : D
2Cr+6 + 6e -> 2Cr+3
2Cl- -> Cl2 + 2e
Bảo toàn e: nCl2.2 = 6nK2Cr2O7
=> nK2Cr2O7 = 0,05 mol
=> mK2Cr2O7 =14,7g