Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức hóa học của photpho: P x O y
%O = 100 – 43,66 = 5,34%
M P x O y = 31x + 16y = 142
Tỉ lệ khối lượng:
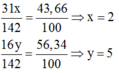
Vậy công thức hóa học của oxit photpho là P 2 O 5 .
Chọn A.

1
Đặt CT: FexOy
Ta có:
MFe:MO=56x\16y= 21\8= 448x\336y
⇒ x\y= 3\4
⇒ x = 3 ; y = 4
⇒ CT của oxit sắt: Fe3O4
⇒ Fe3O4 có PTK: 3.56+4.16 = 232 đvC
2.
Gọi công thức hóa học của oxit photpho là PxOy
Lập các tỷ số khối lượng:
x×31\142=43,66\100→x≈2
y×16\142=56,34\100→y=5
Công thức hóa học của oxit photpho là P2O5

Ta có: \(\left\{{}\begin{matrix}m_S=64\cdot50\%=32\left(g\right)\\m_O=64\cdot50\%=32\left(g\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_S=\dfrac{32}{32}=1\left(mol\right)\\n_O=\dfrac{32}{16}=2\left(mol\right)\end{matrix}\right.\)
Vậy CTHH là \(SO_2\)

Khối lượng của các nguyên tố trong hợp chất là:
\(m_{FE}=\dfrac{70.160}{100}=112\left(g\right)\)
\(m_O=\dfrac{30.160}{100}=48\left(g\right)\)
Số mol có trong mỗi nguyên tố là:
\(n_{FE}=\dfrac{m_{FE}}{M_{FE}}=\dfrac{112}{56}=2\left(mol\right)\)
\(n_O=\dfrac{m_O}{M_O}=\dfrac{48}{16}=3\left(mol\right)\)
Vậy hợp chất có 2 nguyên tử Fe, 3 nguyên tử O
Công thức hóa học của hợp chất là: \(FE_2O_3\)

Bài 2:
Đặt công thức oxit của phopho là PxOy
Ta có: Phân tử khối của oxit là 142 đvC nên: 30x + 16y = 142 (1)
Thành phần phần trăm của Phopho là 43,66 % ta có:
\(\dfrac{30x}{30x+16y}.100=43,66\)
\(\Rightarrow1690,2x-698,56y=0\left(2\right)\)
Từ (1) và (2) ta có hệ phương trình:
\(\left\{{}\begin{matrix}30x+16y=142\\1690,2x-698,56y=0\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=2\\y=5\end{matrix}\right.\)
Vậy oxit đó là P2O5

1)
PTKR2Ox = 2.NTKR + 16x = 102 (đvC)
| x | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| NTKR | 43(Loại) | 35(Loại) | 27(Al) | 19(Loại) | 11(Loại) | 3(Loại) | Loại | Loại |
=> R là Al
2)
CTHH: RxOy
\(\%R=\dfrac{x.NTK_R}{160}.100\%=70\%\)
=> \(NTK_R=\dfrac{112}{x}\left(đvC\right)\)
Chỉ có x = 2 thỏa mãn \(NTK_R=\dfrac{112}{2}=56\left(đvC\right)\)
=> R là Fe
PTKFe2Oy = 160 (đvC)
=> y = 3
CTHH: Fe2O3

Gọi CTHH cần tìm là PxOy
\(\Leftrightarrow\frac{31x}{16y}=\frac{43,66}{56,34}\)
\(\Leftrightarrow\frac{x}{y}=\frac{2}{5}\Rightarrow5x-2y=0\) \(31x+16y=142\) \(\Rightarrow\left\{{}\begin{matrix}x=2\\y=5\end{matrix}\right.\) Vậy CT của oxi là P2O556,34% khối lượng của oxi nha bạn
\(\%P:\%O=43,66:53,34\)
\(\Rightarrow n_P:n_O=\frac{43,66}{31}:\frac{53,34}{16}=1,4:3,33=2:5\)
PTK:142
=>CTHH:P2O5

Gọi CTHH cần tìm là $P_xO_y$
Ta có :
$\dfrac{31x}{43,4} = \dfrac{16y}{56,6} = \dfrac{142}{100}$
Suy ra : $x = 2 ; y = 5$
Vậy chọn đáp án B

1.\(\dfrac{m_{Al}}{m_O}=\dfrac{9}{8}\)
\(Al_xO_y\)
\(x:y=\dfrac{9}{27}:\dfrac{8}{16}=\dfrac{1}{3}:\dfrac{1}{2}=2:3\)
Vậy CTHH là \(Al_2O_3\)
2.\(\rightarrow\%S=100-60=40\%\)
\(S_xO_y\)
\(x:y=\dfrac{40}{32}:\dfrac{60}{16}=1,25:3,75=1:3\)
Vậy CTHH là \(SO_3\)
3.
a.b.
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(n_{H_2SO_4}=2.0,2=0,4mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 < 0,4 ( mol )
0,2 0,2 0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
Chất dư là H2SO4
\(m_{H_2SO_4\left(dư\right)}=\left(0,4-0,2\right).98=19,6g\)
c.Nồng độ gì bạn nhỉ?
C1: Gọi CTTQ: PxOy
x = \(\frac{43,66\times 142}{31\times 100}\approx 2\)
%O = 100% - 43,66% = 56,34%
y = \(\frac{56,34\times 142}{16\times 100}= 5\)
Vậy CTHH: P2O5
C2: Gọi CTTQ: PxOy
%O = 100% - 43,66% = 56,34%
x : y = \(\frac{43,66}{31} : \frac{56,34}{16}= 1,4 : 3,5 = 2 : 5\)
Vậy CTHH: P2O5