Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử trong 22,2 g hỗn hợp M có x mol C và y mol C n + 1 H 2 n + 4 :
(14n + 2)x + (14n + 16)y = 22,2 (1)
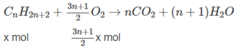
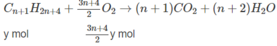
Số mol O 2 :
n
O
2
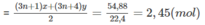
⇒ (3n + 1)x + (3n + 4)y = 4,9 (2)
Nhân (2) với 14: (42n + 14)x + (42n + 56)y = 68,6 (2')
Nhân (1) với 3: (42n + 6)x + (42n + 48)y = 66,6 (1')
Lấy (2') trừ đi (1'): 8x + 8y = 2
x + y = 0,25
Biến đổi (2): 3n(x + y) + x + 4y = 4,9
Thay x + y = 0,25; 0,75n + 0,25 + 3y = 4,9
⇒ 3y = 4,65 - 0,75n
y = 1,55 - 0,25n
Vì 0 < y < 0,25 ⇒ 0 < 1,55 - 0,25n < 0,25
5,2 < n < 6,2
n = 6 ⇒ y = 1,55 - 0,25.6 = 5. 10 - 2
x = 0,25 - 5. 10 - 2 = 0,2
% về khối lượng
C
6
H
14
trong hỗn hợp M: 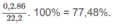
% về khối lượng C 7 H 16

Giả sử trong 6,72 lít A có x mol C n H 2 n + 2 y mol C m H 2 m - 2 .
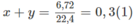
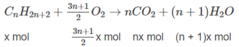
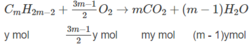
Số mol O 2 :
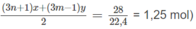
⇒(3n + 1)x + (3m − 1)y = 2,5 (2)
Số mol C O 2 : nx + my = 0,8 (mol)
⇒ (3n + 1)x + (3m - 1)y = 2,5 (3)
Từ (2) và (3) tìm được x - y = 0,1 ;
Kết hợp với X + y = 0,3, ta có: x = 0,2 và y = 0,1 Thay các giá trị tìm được vào (3) ta có
0,2n + 0,1m = 0,8
⇒ 2n + m = 8.
Nếu n = 1 thì m = 6: Loại, vì C 6 H 10 không phải là chất khí ở đktc. Nếu n = 2 thì m = 4. Công thức hai chất là C 2 H 6 và C 4 H 6 .
Nếu n = 3 thì m = 2: Loại vì m > 3.
Trả lời: Hỗn hợp A chứa (66,67%) và C 4 H 6 (33,33%)
Số mol H 2 O = (n + 1)x + (m - 1)y = 0,9 (mol).
2. Khối lượng nước: p = 0,9.18 = 16,2 (g).

Số mol
O
2
: 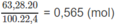
Số mol C O 2 = số mol C a C O 3 = 0,36 (mol).
1. Trong 0,36 mol C O 2 , khối lượng cacbon: 0,36 x 12 = 4,32 (g) và khối lượng oxi: 0,36 x 32 = 11,52 (g).
Khối lượng oxi trong nước là: 0,565 x 32,0 - 11,52 = 6,56 (g).
Khối lương hiđro (trong nước): 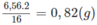
Khối lượng M = khối lượng C + khối lượng H = 4,32 + 0,82 = 5,14 (g)
2. Khi đốt 1 mol ankan, số mol H 2 O tạo ra nhiều hơn số mol C O 2 là 1 mol. Khi đốt hỗn hợp M, số mol H 2 O nhiều hơn số mol C O 2 :
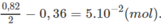
Vậy hỗn hợp M có 5. 10 - 2 mol ankan.
Khối lượng trung bình của 1 mol ankan:
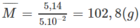
14n + 2 < 102,8 < 14n + 30
⇒ 5,20 < n < 7,20
Đến đây có thể tìm được công thức phân tử và phần trăm khối lượng từng chất như ở cách thứ nhất.

1. Công thức chung của hai ancol là C n H 2 n + 1 O H và tổng số mol của chúng là a. Khối lượng hỗn hợp: (14 n + 18)a.
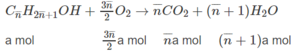
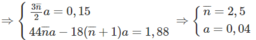
Khối lượng hỗn hợp: (14.2,5 + 18).0,04 = 2,12 (g)
2. n < 2,5 < n + 2 ⇒ 0,5 < n < 2,50
Phần cuối giống như ở cách giải 1.

1. ![]()
Theo phương trình: Cứ (14n + 2) gam ankan tác dụng với 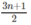 mol
O
2
mol
O
2
Theo đẩu bài: Cứ 1,45 gam ankan tác dụng với 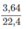 mol
O
2
mol
O
2
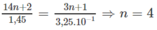
2. CTCT:
CH3-CH2-CH2-CH3 (butan)
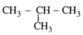
isobutan (2-metylpropan)

Đặt công thức của 2 ancol là C n H 2 n + 1 O H
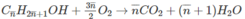
Theo phương trình:
(14
n
+ 18) g ancol tác dụng với 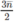 mol
O
2
mol
O
2
Theo đầu bài: 35,6 g ancol tác dụng với 2,850 mol O 2
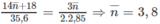
⇒ Hai ancol là C 3 H 7 O H (x mol) và C 4 H 9 O H (y mol)
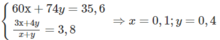
Từ đó tính được phần trăm khối lượng từng chất (như ở trên).

1. Trong dãy đồng đẳng của benzen, chỉ có C 6 H 6 và C 7 H 8 là không có đồng phân là hợp chất thơm.
A và B ở trong dãy đó và MA < MB vậy A là C 6 H 6 và B là C 7 H 8 .
Chất C cách chất A hai chất trong dãy đồng đẳng nghĩa là chất C phải hơn chất A ba nguyên tử cacbon. Công thức phân tử chất C là C 9 H 12 .
2. Giả sử trong 48,8 g hỗn hợp X có a mol A, b mol B và c mol C; ta có :
78a + 92b + 120c = 48,8 (1)
a = c (2)
C 6 H 6 + 7,5 O 2 → 6 C O 2 + 3 H 2 O
a 7.5a
C 7 H 8 + 9 O 2 → 7 C O 2 + 4 H 2 O
b 9b
C 9 H 12 + 12 O 2 → 9 C O 2 + 6 H 2 O
c 12c
7,5a + 9b + 12c 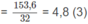
Giải hệ (1), (2), (3), tìm được a = c = 0,2 ; b = 0,1.
Từ đó tính được thành phần phần phần trăm về khối lượng của hỗn hợp X :
C 6 H 6 : 31,9%; C 7 H 8 : 18,9%; C 9 H 12 : 49,2%

Chất A có CTPT là C n H 2 n O 2 , CTCT là C n - 1 H 2 n - 1 C O O H Chất B có CTPT là C n H 2 n + 2 O , CTCT là C n H 2 n + 1 O H .
Phần (1):
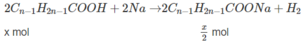
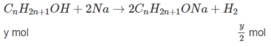
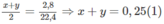
Phần (2) :
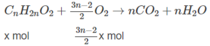
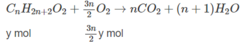
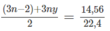
⇒ (3n − 2)x + 3ny = 1,3 (2)
Khối lượng mỗi phần : (14n + 32)x + (14n + 18)y = 12,9 (3)
Từ hệ các phương trình (1), (2), (3), tìm được n = 2; x = 0,1; y = 0,15.
Chất A: C 2 H 4 O 2 hay C H 3 C O O H (axit axetic) chiếm :
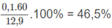
khối lượng hỗn hợp.
Chất B: C 2 H 6 O hay C H 3 - C H 2 - O H (ancol etylic) chiếm: 100% - 46,5% = 53,5% khối lượng hỗn hợp.

Khi đốt 0,5 mol hỗn hơp M, số mol C O 2 thu đươc là :
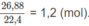
Nếu đốt 1 mol hỗn hợp M, số mol C O 2 thu được sẽ là 2,4 (mol).
Như vậy chất A và chất B có chứa trung bình 2,40 nguyên tử cacbon , chất A lại kém chất B 1 nguyên tử cacbon. Vậy, A có 2 và B có 3 nguyên tử cacbon.
A là ancol no có 2 cacbon: C 2 H 6 - x ( O H ) x hay C 2 H 6 O x
B là axit đơn chức có 3 cacbon: C 3 H y O 2 .
Đặt số mol A là a, số mol B là b :
a + b = 0,5 (1)
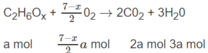
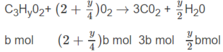
Số mol O 2 là: (3,5 - 0,5x)a + (2 + 0,25y)b = 1,35 (mol) (2)
Số mol C O 2 là: 2a + 3b = 1,2 (mol) (3)
Số mol C O 2 là:
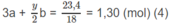
Giải hệ phương trình đại số tìm được: a = 0,3; b = 0,2; x = 2; y = 4.
Chất A:
C
2
H
6
O
2
hay 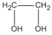 etanđiol (hay etylenglicol)
etanđiol (hay etylenglicol)
Chiếm  khối lượng M.
khối lượng M.
Chất B: C 3 H 4 O 2 hay C H 2 = C H - C O O H , axit propenoic chiếm 43,64% khối lượng M.
Đặt lượng C 7 H 16 là x mol, lượng C 8 H 18 là y mol.
100x + 114y = 6,95 (1)
C 7 H 16 + 11 O 2 → 7 C O 2 + 8H2O
x mol 11x mol
2 C 8 H 18 + 25 O 2 → 16 C O 2 + 18 C O 2
y mol 12,5 y mol
11x + 12,5y = 0,7625 (2)
Từ (1) và (2), tìm được x = 0,0125; y = 0,05.
% về khối lượng của C 7 H 16 :
% về khối lượng của C 8 H 18 : 100% - 18% = 82,0%.