Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 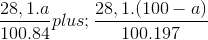 = 0,2
= 0,2
=> a = 29,89.

Số mol H3PO4: 0,050 x 0,50 = 0,025 (mol).
H3PO4 + 3NaOH → Na3PO4 + 3H2O
1 mol 3 mol
0,025 mol 3 x 0,025 mol
Thể tích dung dịch NaOH: 0,075 lít hay 75 ml

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

VO2(pư)=1/5Vkk=8.4(l).theo bài ra ta có nCO2+N2=44.8/22.4=2(1)lại có dB/H2=15=>nCO2/nN2=1/7(2).từ (1)và(2)=>nCO2=0.25(mol)và nN2=1.75(mol).
áp dụng ĐLBTKL ta có m=mCO2+mH2O+mN2-mO2(pư)=57(gam).ta lại có mC+mH+mN=nCO2.12+2.nH2O+28.nN2=53(gam) <57(gam)=>trong A có nguyên tố oxi mO=57-53=4(gam).gọi CTĐGN của A là CxHyOzNt ta có:x:y:z:t=nCO2:2nH2O:nO:2nN2=1:4:1:14=>CTĐGN của A:CH4ON14.lại có 12n+4n+16n+196n=600(tớ nghĩ phải là 600 chứ A chứa nhiều nguyên tố lắm)=>n=3=>CTHH của A:C3H12O3N42.

Để điều chế phân đạm NH4NO3 cần phải có NH3 và HNO3.
Từ không khí, than, nước, có thể lập sơ đồ điều chế phân đạm NH4NO3 như sau:
 → NO → NO2 → HNO3 → NH4NO3
→ NO → NO2 → HNO3 → NH4NO3
C + O2 → CO2: cung cấp nhiệt cho các phản ứng.
Có thể tính như sau: Trong 310 gam Ca3(PO4)2(3CaO.P2O5) có chứa x gam P2O5.
Từ đó ta tính được khối lượng P2O5: x = 142 x (35 : 310) = 16 (g)
Hàm lượng P2O5 là 6%.

Chọn D.
Trong 1 lít nước cứng tren có chứa Ca2+ 0,004 M; Mg 2+ 0,004 M
Cần 0,008 mol để kết tủa hết Ca2+ , Mg 2+ ⇒ n N a 2 C O 3 = 0 , 008 ⇒ V = 40 m l


Chọn D.
Tổng mol Ca2+, Mg2+ trong mẫu nước cứng là 0,005 mol Þ HCO3-: 0,01 mol.
Để kết tủa hoàn toàn thành CaCO3 thì: 0,01 = 0,002 + 0,05x Þ x = 0,16 = 160 ml