Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Hướng dẫn X thuộc nhóm IA,IIA nên có điện hóa trị +1,+2
Y thuộc cùng nhóm VIA,VIIA nên Y có điện hóa trị -2 và -1
Ngoài ra ZX + ZY = 20. Vì X, Y thuộc hai chu kì kế cận nên nghiệm thích hợp là
ZX = 11 thì ZY = 9 ; X là Na , Y là F và XY là NaF
ZX = 12 thì ZY = 8 ; X là Mg , Y là O và XY là MgO

Đáp án D
Ta có:
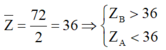
⇒ B thuộc chu kì 5 và A thuộc chu kì 3
B thuộc chu kì 5 nhóm VIIA ⇒ B là Iot
A thuộc chu kì 4 nhóm IA ⇒ A là Kali
Nhận xét các đáp án:
A sai.
B sai: Ion hầu như không tan trong nước
C sai: Ở điều kiện thường Iot là chất rắn màu, dạng tinh thể màu đen
D đúng: KI là thành phần của muối Iot cung cấp iot phòng tránh bệnh bướu cổ

Đáp án D
Ta có:
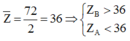
B thuộc chu kì 5 và A thuộc chu kì 3
B thuộc chu kì 5 nhóm VIIA B là Iot
A thuộc chu kì 4 nhóm IA A là Kali
Nhận xét các đáp án:
A sai.
B sai: Ion hầu như không tan trong nước
C sai: Ở điều kiện thường Iot là chất rắn màu, dạng tinh thể màu đen
D đúng: KI là thành phần của muối Iot cung cấp iot phòng tránh bệnh bướu cổ

B
Theo bài ra:
Cấu hình electron lớp ngoài cùng của X có dạng: n s 2 n p 1
Cấu hình electron lớp ngoài cùng của Y có dạng: n s 2 n p 6
Vậy A sai do X ở nhóm IIIA.
C sai do Y thuộc nhóm VIIIA.
D sai do X là nguyên tố p.

Zx+zy=51
Hai nhóm liên kết nhau ở chu kỳ 4
=> TH1: zy-zx=1
=>TH2: zy-zx=11

Nhận thấy hợp chất A có dạng X2Y.
Dễ nhận thấy X+ trong tất cả các đáp án là NH4+ hoặc lập luận như sau:
• Với ion X+ chứa 5 hạt nhân của 2 nguyên tố → X có dạng AaBb+ với a+ b = 5
Trong X+ có 10 electron → Ztb =
10
+
1
5
= 2,2 → trong X chắc chắn chứa H → X có dạng HaBb
Với a = 1, b= 4 → ZB =
11
-
1
4
= 2,5 loại
Với a = 2, b= 3 → ZB =
11
-
2
3
= 3 ( loại do B(Z= 3) không tạo được liên kết ion với H)
Với a = 3, b= 2 → ZB =
11
-
3
2
= 4 ( Loại do không tồn tại ion C2H3+)
Với a= 4, b= 1 → ZB =
11
-
4
1
= 7 (N) → X là NH4+ ( thỏa mãn)
•Trong ion Y2- có bốn hạt nhân → Y có dạng CcDd với c + d= 4 ( Loại C, D)
Trong ion Y2- có bốn hạt nhân thuộc hai nguyên tố trong cùng một chu kì và đứng cách một ô trong bảng hệ thống tuần hoàn. → ZD = ZC + 2
Với c=1, d= 3 → ZC + 3. (ZC +2) = 30 → ZC = 6 ( C) → ZD = 8(O). Vậy Y2- có công thức CO32-.
Với c= 2,d= 2 → 2ZC + 2. (ZC +2) = 30 → ZC = 6,5 ( loại)
Với c= 3, d= 1→ 3ZC + (ZC +2) = 30 → ZC = 7 (N), ZD = 9 (F) → loại do không tạo được ion N3F2-.
Công thức của A là (NH4)2CO3.
Đáp án A.

Đáp án B
Ta có:
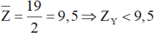
⇒ Y thuộc chu kì 1 hoặc 2
TH1: Y thuộc chu kì 1 ⇒ X là Hidro (Z = 1)
![]() (loại)
(loại)
TH2: Y thuộc chu kì 2
![]()
⇒ X thuộc chu kì 3
Từ đó ta có
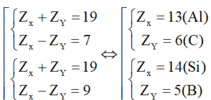
⇒
![]() là Al4C3 hoặc B3Si4
là Al4C3 hoặc B3Si4
Mặt khác trong phân tử ![]() có tổng số proton là 70.
có tổng số proton là 70.
⇒
thử lại ta có ![]() là Al4C3
là Al4C3
Nhận xét các đáp án:
A sai: tổng số nguyên tử trong phân tử ![]() là 7
là 7
B đúng:
![]()
C sai: Ở trạng thái cơ bản cấu hình electron của Y có 2 electron độc thân
D sai: Ở nhiệt độ cao C phản ứng được với Al tạo nhôm cacbua
* Trường hợp 1: X thuộc nhóm IA, Y thuộc nhóm VIIA
Z(X) + Z(Y) = 20 => Z(X) < 20 => X có thể là H (Z = 1), Li (Z = 3), Na (Z = 11), K (Z = 19)
tương ứng với các nguyên tố trên, Y sẽ có Z = 19 (loại), Z = 17 (Cl), Z = 9 (F) và Z = 1 (loại)
=> Có 2 hợp chất phù hợp là LiCl và NaF
* Trường hợp 2: X thuộc nhóm IIA, Y thuộc nhóm VIA
Z(X) + Z(Y) = 20 => Z(X) < 20 => X có thể là Be (Z = 4) và Mg (Z = 12)
tương ứng với X ở trên, Y sẽ có Z = 16 (S) và Z = 8 (O)
=> Có 2 hợp chất phù hợp là BeS và MgO
Tham khảo