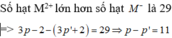Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\left\{{}\begin{matrix}2Z_A+N_A=140\\2Z_A=65,714\%.140\end{matrix}\right.\)
=>\(\left\{{}\begin{matrix}Z_A=46\\N_A=48\end{matrix}\right.\)
Hợp chất A tạo thành từ ion M+ và X2-
=> CT A: M2X
\(\left\{{}\begin{matrix}2Z_M+2N_M+Z_X+N_X=46+48\\Z_M+N_M-\left(Z_X+N_X\right)=23\end{matrix}\right.\)
=> \(3Z_M+3N_M=117\)
=> \(Z_M+N_M=39\)
Ta có A\(\approx\) MM
=> M là Kali (Z=19)
Ta có : \(2Z_M+2N_M+Z_X+N_X=94\)
=> \(2.39+Z_X+N_X=94\)
=> \(Z_X+N_X=16\)
=> X là O
=> CT của A : K2O

Nhận thấy hợp chất A có dạng X2Y.
Dễ nhận thấy X+ trong tất cả các đáp án là NH4+ hoặc lập luận như sau:
• Với ion X+ chứa 5 hạt nhân của 2 nguyên tố → X có dạng AaBb+ với a+ b = 5
Trong X+ có 10 electron → Ztb =
10
+
1
5
= 2,2 → trong X chắc chắn chứa H → X có dạng HaBb
Với a = 1, b= 4 → ZB =
11
-
1
4
= 2,5 loại
Với a = 2, b= 3 → ZB =
11
-
2
3
= 3 ( loại do B(Z= 3) không tạo được liên kết ion với H)
Với a = 3, b= 2 → ZB =
11
-
3
2
= 4 ( Loại do không tồn tại ion C2H3+)
Với a= 4, b= 1 → ZB =
11
-
4
1
= 7 (N) → X là NH4+ ( thỏa mãn)
•Trong ion Y2- có bốn hạt nhân → Y có dạng CcDd với c + d= 4 ( Loại C, D)
Trong ion Y2- có bốn hạt nhân thuộc hai nguyên tố trong cùng một chu kì và đứng cách một ô trong bảng hệ thống tuần hoàn. → ZD = ZC + 2
Với c=1, d= 3 → ZC + 3. (ZC +2) = 30 → ZC = 6 ( C) → ZD = 8(O). Vậy Y2- có công thức CO32-.
Với c= 2,d= 2 → 2ZC + 2. (ZC +2) = 30 → ZC = 6,5 ( loại)
Với c= 3, d= 1→ 3ZC + (ZC +2) = 30 → ZC = 7 (N), ZD = 9 (F) → loại do không tạo được ion N3F2-.
Công thức của A là (NH4)2CO3.
Đáp án A.

Đáp án D
Hợp chất Y được cấu tạo từ ion M+ và ion X- Hợp chất Y là MX
Theo giả thiết ta có:
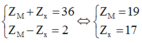
=> M là Kali và X là Cl
K có cấu hình electron là: 1s22s22p63s23p64s1
=> K thuộc chu kì 4; nhóm IA
Cl có cấu hình electron là: 1s22s22p63s23p5
=> Cl thuộc chu kì 3; nhóm VIIA

Đáp án D
Hợp chất Y được cấu tạo từ ion M+ và ion X-
⇒ Hợp chất Y là MX
Theo giả thiết ta có:

⇒ M là Kali và X là Cl
K có cấu hình electron là: 1s22s22p63s23p64s1
⇒ K thuộc chu kì 4; nhóm IA
Cl có cấu hình electron là: 1s22s22p63s23p5
⇒ Cl thuộc chu kì 3; nhóm VIIA

1/Đặt Z, N lần lượt là số hạt p, n có trong nguyên tử M
ta có hệ phương trình
\(\begin{cases}2Z+N=79+3\\2Z-N=19+3\end{cases}\)\(\Rightarrow\begin{cases}Z=26\\N=30\end{cases}\)
a. Cấu hình electron nguyên tử của M là: 1s22s22p63s23p63d64s2
M ở ô thứ 26, chu kì 4 nhóm VIIIB trong bảng tuần hoàn.
b. Cấu hình electron của ion Fe2+ là: 1s22s22p63s23p63d6
Cấu hình electron của ion Fe3+ là: 1s22s22p63s23p63d5
2.
Vì R tạo được hợp chất khí với H nên R là phi kim.
Giả sử R thuộc nhóm x (x\(\ge\)4).
Theo giả thiết
công thức của R với H là RH8-x \(\Rightarrow\)a=\(\frac{R}{R+8-x}.100\)
công thức oxit cao nhất của R là R2Ox
\(\Rightarrow\) b=\(\frac{2R}{2R+16x}.100\) \(\Leftrightarrow\) b= \(\frac{R}{R+8x}.100\)
suy ra \(\frac{a}{b}=\frac{R+8x}{R+8-x}=\frac{11}{4}\)\(\Leftrightarrow R=\frac{43x-88}{7}\)
Xét bảng
x R 4 5 6 7 12 có C 18,14 loại 24,28 loại 30,42 loại
a/ Vậy R là C
b/
Công thức của R với H là CH4
Công thức electron C : H : H : H : H ; Công thức cấu tạo C - H - - - H H H
Oxti cao nhất của R là CO2
Công thức electron O:: C ::O; Công thức cấu tạo O=C=O
c.
Trong hợp chất CH4 có \(\Delta\chi=\chi_C-\chi_H\)=2,55-0,22=0,35<0,4 nên liên kết giữa C-H là liên kết cộng hóa trị không cực
Trong hợp chất CO2 có 0, \(\Delta\chi=\chi_O-\chi_C\) =3,44-2,55=0,89
\(\Rightarrow\) 0,4<\(\Delta\chi=0,89\)<1,7 nên liên kết giữa C=O là liên kết cộng hóa trị phân cực

Đáp án C.
Tổng số hạt trong phân tử Y là 214 hạt.
4(2pM + nM) + 3(2pX + nX) = 214 (1)
Ion M3+ có số electron bằng số electron của ion X4 −
pM - 3 = pX + 4 => pX = pM - 7 (2)
Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố M nhiều hơn tổng số hạt của nguyên tử nguyên tố X trong Y là 106
4(2pM + nM) - 3(2pX + nX) = 106 (3)
(1), (3) => 2pM + nM = 40 (4) và 2pX + nX = 18 (5)
(5),(2),(4) => pX = 6 ; pM = 13 => X là C (Carbon) và M là Al (Nhôm)
Y la Al4C3 (Nhôm carbua)

Đáp án C.
Gọi p, e, n là số proton, số electron và số nơtron trong một nguyên tử M; p’, e’, n’ là số proton, số electron và số nơtron trong một nguyên tử X.
Trong nguyên tử số proton = số electron; các hạt mang điện là proton và electron, hạt không mang điện là nơtron.
+ Trong phân tử của M2X2 có tổng số hạt proton, nơtron và electron là 164 nên suy ra:
2(2p + n) + 2(2p’ + n’) = 164 (1)
+ Trong đó số hạt mang điện nhiều hơn hạt không mang điện là 52 nên suy ra:
(4p + 4p’) - 2(n + n’) = 52 (2)
+ Số khối của M lớn hơn số khối của X là 23 đơn vị nên ta có suy ra:
(p + n) - (p’ + n’) = 23 (3)
+ Tổng số hạt electron trong M+ nhiều hơn trong X22- là 7 hạt nên suy ra:
(2p + n - 1) - 2(2p’ + n’) + 2 = 7 (4)
Giải hệ (1), (2), (3), (4) ta được p = 19 ⇒ M là kali; p’ = 8 ⇒ X là oxi.
Công thức phân tử của hợp chất là K2O2.

Xác định X+
X+ có 10 electron nên tổng proton trong 5 hạt nhân là 11
Z = 2,2. Vậy có 1 nguyên tử là H
Gọi nguyên tử thứ hai trong X+ là R, công thức X+ có thể là;
RH4+ : ZR + 4 = 11 → ZR = 7 (N) ; X+: NH4+ (nhận)
R2H3+ : 2ZR + 3 = 11 ZR = 4 loại : R3H2+ : 3ZR + 2 = 11 ZR = 3 loại
Xác định Y2-
Y2- có 32 eletron nên tổng số hạt proton trong 4 nguyên tử là 30.
= 7,5 2 nguyên tử trong Y2- đều thuộc cùng chu kỳ 2.
Gọi 2 nguyên tử là A, B: ZB = ZA +2
Công thức Y2- có thể là
AB32- : ZA + 3ZB = 30
ZB= ZA +2 ZA= 6 (C); ZB = 8 (O)
A2B22- : 2ZA+ 2ZB = 30
ZB = ZA + 2 ZA= 6,5; ZB = 8,5 loại
A3B2- : 3ZA + ZB = 30
ZB = ZA + 2 ZA = 7; ZB = 9 loại
Hợp chất A có công thức (NH4)2CO3
Ta có trong X+ nhé
Có 2 nguyên tố là a và b
Vì có 5 hạt nhân tức là có 5 nguyên tử mà chỉ có 10 e -> Chắc chắn phải có Hidro ( chứ nếu sang tới B là có tới 3 e rồi!)
Biện luận về số nguyên tử hidro và số e của nguyên tố còn lại (ntcl)<--- lưu ý là ion X+ có 10 -> tổng 2 nguyên tố có đến 11 e
Số Hidro : 1------2------3-----4
Số ntcl : 4------3------2-----1
Số e của ntcl:2.5----3------4-----7
Ta thấy chỉ có giá trị 4-1-7 là phù hợp bởi vì 2,5 lẻ bị loại, 3,4 là các nguyên tố kim loại ko tạo ion với Hiđro
Tra bảng tuần hoàn ta có số hiệu 7 là nguyên tố Nitơ. -> X+ là NH4+
Tổng số e trong Y 2- là 32 <=> tổng số e của 4 nguyên tố tạo nên Y2- là 30
Gọi số e của nguyên tố thứ nhất là a thì̀ số e của nguyên tố thứ 2 là a+2
lại gọi thêm số nguyên tử của 2 nguyên tố lần lượt là x,y thì ta có
x+y=4
xa + y(a+2) = 30 <=> xa + ya =28 - 2y <=> (x+y)a= 28 - 2y <=> 4a = 28 - 2y
biện luận
y-----1---------2---------3
a----6.5-----6.25------6
tới đây dừng vì y<4 ta thấy có 1 nguyên tố có 1 nguyên tử mang số hiệu 6 (oxi) -> nguyên tố còn lại mang số hiệu 8 (cacbon) và có 3 nguyên tử -> Y2- là CO3(2-)
-> A chính là ..... (NH4)2CO3