Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

V 0 ≈ 1,889 lít. Vì áp suất quá lớn nên khí không thể coi là khí lí tưởng. Do đó kết quả tìm được chỉ là gần đúng.

1/ Quá trình biến đổi trạng thái khi thể tích không đổi gọi là đẳng tích
Định luật: Trong quá trình đẳng tích của một lượng khí nhất định, áp suất tỉ lệ thuận với nhiệt độ tuyệt đối
Biểu thức:
\(\frac{P}{T}=\) hằng số
+Lưu ý: Nếu gọi \(P_1,T_1\) là áp suất và nhiệt độ tuyệt đối của 1 lượng khí ở trạng thái 1
Nếu gọi \(P_2,T_2\) là áp suất và nhiệt độ tuyệt đối của 1 lượng khí ở trạng thái 2
Ta có biểu thức: \(\frac{P_1}{T_1}=\frac{P_2}{T_2}\)
2/ Phương trình trạng thái khí lí tưởng:
\(\frac{p_1V_1}{T_1}=\frac{p_2V_2}{T_2}\)
Tính ra \(p_2=2,58atm\)

Đáp án C
Trạng thái 1: V1 = ? ; p1 =l atm;
Trạng thái 2: V2 = 201 ; p2 = 25 atm.
Vì quá trình là đẳng nhiệt, nên ta áp dụng định luật Boyle- Mariotte cho hai trạng thái khí (1) và (2):
p1.V1 = p2.V2 ⇒ 1.V1 = 25.20 => V1 = 500 lít

Biết ρ 0 = m/ V 0 và ρ = m/V ⇒ ρ 0 V 0 = ρ V
Mặt khác p 0 V 0 = pV
(vì nhiệt độ của khí bằng nhiệt độ ở điều kiện chuẩn).
Từ (1) và (2) suy ra:
ρ = ρ 0 p/ p 0 = 1,43.150/1 = 214,5(kg/ m 3 )
Và m = 214,5. 10 - 2 = 2,145 kg.

Gọi \(m_1;m_2\) là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: \(pV=\frac{m_1}{\mu}RT_1;pV=\frac{m_2}{\mu}RT_2\)
Từ đó suy ra khối lượng khí đã thoát ra:
\(m_2-m_1=\frac{pV\mu}{R}\left(\frac{1}{T_1}-\frac{1}{T_2}\right)\), với \(p=50atm,V=10\)lít \(,\mu=2g\)
\(R=0,084atm.l\text{/}mol.K;\)\(T_1=7+273=280K\)
\(T_2=17+273=290K\). Suy ra \(m_2-m_1=1,47g\)
Gọi m1,m2m1,m2 là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: pV=m1μRT1,pV=m2μRT2pV=m1μRT1,pV=m2μRT2
Từ đó suy ra khối lượng khí đã thoát ra:
m2−m1=pVμR(1T1−1T2)m2−m1=pVμR(1T1−1T2), với p=50atm,V=10lít,μ=2gp=50atm,V=10lít,μ=2g
R=0,084atm.l/mol.K;T1=7+273=280KR=0,084atm.l/mol.K;T1=7+273=280K
T2=17+273=290KT2=17+273=290K. Suy ra m2−m1=1,47g

Bài giải.
+ Trạng thái 1:
p1 = 750 mmHg
T1 = 300 K
V1 = 40 cm3
+ Trạng thái 2 :
P0 = 760 mmHg
T0 = 273 K
V0 = ?
+ Phương trình trạng thái :
\(\dfrac{p_0V_0}{T_0}=\dfrac{p_1V_1}{T_1}\Rightarrow V_0=\dfrac{p_1V_1}{T_1}.\dfrac{T_0}{p_0}\)
\(V_0=\dfrac{750.40.273}{760.300}=36cm^3\)
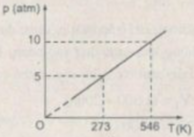
Tóm tắt:
\(p_1=10atm\\ V_1=20l\\ T_1=t_1+273=546K\)\(p_2=1atm\\ T_2=t_2+273=273K\\ V_2=?\)
Áp dụng phương trình trạng thái của khí lý tưởng:
\(\frac{p_1V_1}{T_1}=\frac{p_2V_2}{T_2}\Rightarrow V_2=\frac{p_1V_1T_2}{T_1p_2}=\frac{10\cdot20\cdot273}{546\cdot1}=100l\)
P/s: Bạn có thể tìm liên hệ giữa V1 và V2 qua các thông số đó vẫn được nha
#Lemon