Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta thấy trong X có các ancol có đặc điểm: số C = số nhóm OH
=> Khi đốt cháy X : \(n_{CO_2}=n_{C\left(X\right)}=n_{OH}=0,25mol\)
=> Khi phản ứng vớ Na => \(n_{H_2}=\frac{1}{2}n_{OH}=0,125mol\)
=> V = 2,8 lít

nancol = 2nH2 = 0,05 (mol)
Mancol = 32 \(\rightarrow\) C2H5OH
CH3\(-\)CH2\(-\)OH + CuO \(\underrightarrow{t^o}\) CH3\(-\)CH\(=\)O + Cu \(\downarrow\)+ H2O
CH3\(-\)CH2\(-\)OH \(\xrightarrow[140^oC]{H_2SO_4đ}\) C2H5\(-\)O\(-\)C2H5

Ta có: \(n_{COOH\left(X\right)}=n_{CO_2}=0,7mol\)
Khi đốt X có: \(n_{CO_2}=0,4mol;n_{CO_2}=0,8mol\)
Theo ĐLBT oxi có \(n_O=2n_{COOH\left(X\right)}+2n_{O_2}=2n_{CO_2}+n_{H_2O}\)
\(\Rightarrow n_{H_2O}=y=0,6mol\)

ý C
số mol H2 = 0.025(mol)
Từ phương trình : vì số mol X = 2 số mol H2 ⇒ số mol X = 0.05(mol)
Vì khối lượng X = 3,79 (g) ⇒ Mx = 74 (g/mol)
n = 4 thì mới thỏa mãn Mx= 74

Khối lượng bình (1) tăng 0,63g chính là khối lượng H2O.
\(\Rightarrow m_H=\frac{0,63}{18}.2=0,07g\)
Ở bình (2) : \(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
\(0,05\leftarrow\frac{5}{100}=0,05\)
\(\Rightarrow m_C=0,05.12=0,6g\)
\(\Rightarrow m_O=0,67-\left(m_C+m_H\right)=0\)
\(\Rightarrow\%m_C=\frac{0,6}{0,67}.100=89,55\%\)
\(\%m_H=100\%-89,55\%=10,45\%\)
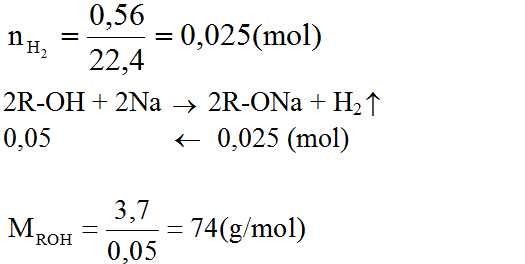
Lời giải:
Công thức của Ancol là : CnH2n+2Om
nH2 = 0,1 ⇒ nOH- = 0,2 ⇒ nAncol = 0,2/m ⇒ nC = n.0,2/m
Ancol no ⇒ nAncol = nH2O – nCO2 ⇒ nH = 2.(0,2/m + 0,2n/m)
7,6 = mC + mH + mO
⇒ 7,6 = 12n . 0,2/m + 2.(0,2/m + 0,2n/m) + 0,2.16
⇒ 7n + 1 = 11m .
Đáp án A.