Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Nguyên tử X có 16 proton => Nguyên tử S
- Số proton = số hiệu nguyên tử = 16 => Z = 16
- Số khối = số proton + số neutron = 16 + 16 = 32
=> Kí hiệu nguyên tử X: \({}_{16}^{32}S\)
Đáp án C

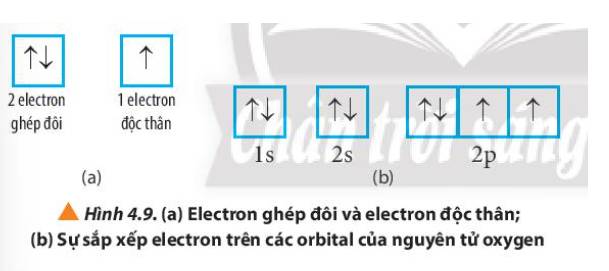
- Nguyên tử oxygen có:
+ 6 electron ghép đôi nằm ở orbital 1s, 2s và 1 orbital 2p
+ 2 electron độc thân nằm ở 2 orbital 2p
Nguyên tử oxygen có 6 electron ghép đôi và 2 electron độc thân.

- Có 7 quả cầu màu xanh => 7 electron
- Có 7 quả cầu màu đỏ => 7 proton
- Có 7 quả cầu màu xám => 7 neutron
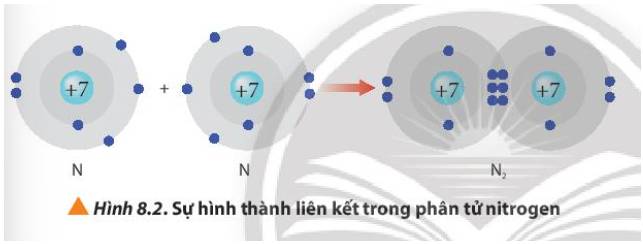
Dựa vào mô hình ta thấy: Nguyên tử nitrogen có 7 proton, 7 neutron và 7 electron.

Sau khi tham gia liên kết, nguyên tử nitrogen 8 electron ở lớp ngoài cùng và có 2 lớp electron
=> Đạt được cấu hình electron bền vững của nguyên tử khí hiếm Neon

- Trong phân tử phosphorus trichloride gồm 2 nguyên tố: P và Cl
+ Nguyên tử P có 5 electron ở lớp ngoài cùng => Góp chung 3 electron độc thân để hình thành 3 liên kết cộng hóa trị
+ Nguyên tử Cl có 7 electron ở lớp ngoài cùng => 3 nguyên tử Cl, mỗi nguyên tử góp chung 1 electron độc thân để hình thành 3 liên kết cộng hóa trị với P.
=> Khi đó, quanh P và Cl đều có 8 electron như khí hiếm Argon.
- Công thức Lewis của phân tử:

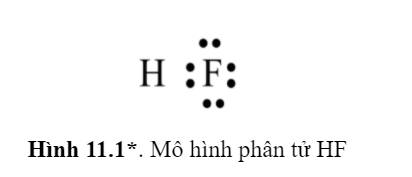
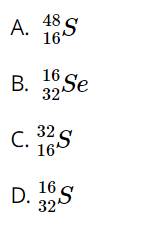



- Nguyên tố H và F sẽ góp chung 1 electron để đạt cấu hình electron bền vững.
⟹ Số electron chung là: 2
- H có hóa trị cao nhất là I ⟹ Electron hóa trị riêng của H là 1.
- F có hóa trị cao nhất là IIV ⟹ Electron hóa trị riêng của F là 7.