
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1 đốt
2 cô cạn
3 2,3
4 hạt proton
5 đơn vị cacbon ( đvc )
6 proton electron
7 electron
8 4 . 48335 x 10-23
9 số hạt proton bằng số hạt electron
10 vì khối lượng của electron ko đáng kể
11 proton , nơtron , electron
12 có cùng số proton trog hạt nhân (các nguyên tử cùng loại )
13 sắt , chì , kẽm , thủy ngân
14 Oxi , nitơ , cacbon , clo
15 2 đơn chất 4 hợp chất
16 Fe , O2 , Cl2 , P , Na
17 Na2O , HNO3 , CO2 , CaO , BaCl2
18 342 đvc
19 2O2
20 HNO3
21 P2O5
22 2 nguyên tử Al , 3 nguyên tử S , 4 nguyên tử O
23 CaO , Al2O3 , K2OO
24 Ba3 (PO4)2
25 CO3
26 XY
27 X3Y2
bn nhé

Bài này dễ em tự làm được mà, nhớ lại các tính chất hóa học của kim loại và oxit là giải quyết được.
P/s: Chữ đẹp v~ =]]

Câu 6:
nAl=3,24/27=0,12(mol); nO2= 4,48/22,4=0,2(mol)
PTHH: 4 Al + 3 O2 -to-> 2 Al2O3
Ta có: 0,12/4 < 0,2/3
=> O2 dư, Al hết, tính theo nAl
=> nAl2O3(LT)= nAl/2= 0,12/2=0,06(mol)
nAl2O3(TT)=4,59/102=0,045(mol)
=> H= (0,045/0,06).100= 75%
Câu 7:
nMg=6/24=0,25(mol); nS= 8,8/32=0,275(mol)
PTHH: Mg + S -to-> MgS
Ta có: 0,25/1 < 0,275/1
=> Mg hết, S dư, tính theo nMg
=> nMgS(LT)=nMg= 0,25(mol)
nMgS(TT)= 10,08/56= 0,18(mol)
=>H= (0,18/0,25).100=72%


1) a. Zn+2HCl \rightarrow ZnCl_2+H_2Zn+2HCl→ZnCl2+H2.
b. Số mol Zn: n_Zn=\dfrac{32,5}{65}=0,5 molnZn=6532,5=0,5mol.
Theo PTHH: 1 mol Zn-----> 1 mol H_2H2.
\Rightarrow 0,5 mol Zn----> 0,5 mol H_2H2.
Thể tích H_2H2: V_{H_2}=22,4.0,5=11,2 lVH2=22,4.0,5=11,2l.
c. Theo PT: 1 mol Zn-----> 1 mol ZnCl_2ZnCl2
\Rightarrow 0,5 mol Zn----> 0,5 mol ZnCl_2ZnCl2.
Khối lượng kẽm clorua: m_{ZnCl_2}=0,5.136=68 gmZnCl2=0,5.136=68g.
4) a. PTHH: 2Al+6HCl \rightarrow 2AlCl_3+3H_22Al+6HCl→2AlCl3+3H2.
b. Số mol Al: n_{Al}=\dfrac{5,4}{27}=0,2 molnAl=275,4=0,2mol
Theo PT: 2 mol Al-----> 3 mol H_2H2.
\Rightarrow 0,2 mol Al-----> 0,3 mol H_2H2.
Thể tích H_2H2 thu được: V_{H_2}=22,4.0,3=6,72 lVH2=22,4.0,3=6,72l.
c. Theo PT: 2 mol Al------> 2 mol AlCl_3AlCl3
\Rightarrow 0,2 mol Al------> 0,2 mol AlCl_3AlCl3.
Khối lượng nhôm clorua: m_{AlCl_3}=0,2.133,5=26,7 gmAlCl3=0,2.133,5=26,7g
- Trả lời
1) a. Zn+2HCl \rightarrow ZnCl_2+H_2Zn+2HCl→ZnCl2+H2.
b. Số mol Zn: n_Zn=\dfrac{32,5}{65}=0,5 molnZn=6532,5=0,5mol.
Theo PTHH: 1 mol Zn-----> 1 mol H_2H2.
\Rightarrow 0,5 mol Zn----> 0,5 mol H_2H2.
Thể tích H_2H2: V_{H_2}=22,4.0,5=11,2 lVH2=22,4.0,5=11,2l.
c. Theo PT: 1 mol Zn-----> 1 mol ZnCl_2ZnCl2
\Rightarrow 0,5 mol Zn----> 0,5 mol ZnCl_2ZnCl2.
Khối lượng kẽm clorua: m_{ZnCl_2}=0,5.136=68 gmZnCl2=0,5.136=68g.
4) a. PTHH:

3.
a) Số mol khí \(H_2\) = 1 mol
b) Số mol nguyên tử cacbon = 1 mol
c) Số mol phân tử nước = 1 mol
4.
Không thể dùng đại lượng mol để tính số người , vật thể khác như bàn , ghế,xe... Vì mol là đại lượng chỉ dùng để chỉ số hạt có kích thước vô cùng nhỏ như nguyên tử , phân tử ... mà bằng mất thường sẽ ko nhìn thấy đc

haizz
dừ ước j đề cx dễ như rk m hè
khổ
t hc nát óc r` mà có vô dc j mô ![]()
![]()

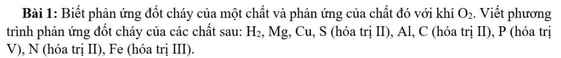


















 Giải giúp mk đề thi này ik~~tks mb~~^^
Giải giúp mk đề thi này ik~~tks mb~~^^




 giúp mik vs nha.Mik cần gấp.Ai làm thì mik cx tick hết á:)cảm ơn nha
giúp mik vs nha.Mik cần gấp.Ai làm thì mik cx tick hết á:)cảm ơn nha








 Đề cg hóa
Đề cg hóa
\(2H_2+O_2\rightarrow2H_2O\)
\(4Mg+O_2\rightarrow2Mg_2O\)
\(2Cu+O_2\rightarrow2CuO\)
\(2S+O_2\rightarrow2SO\)
\(4Al+3O_2\rightarrow2Al_2O_3\)
\(2C+O_2\rightarrow2CO\)