Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

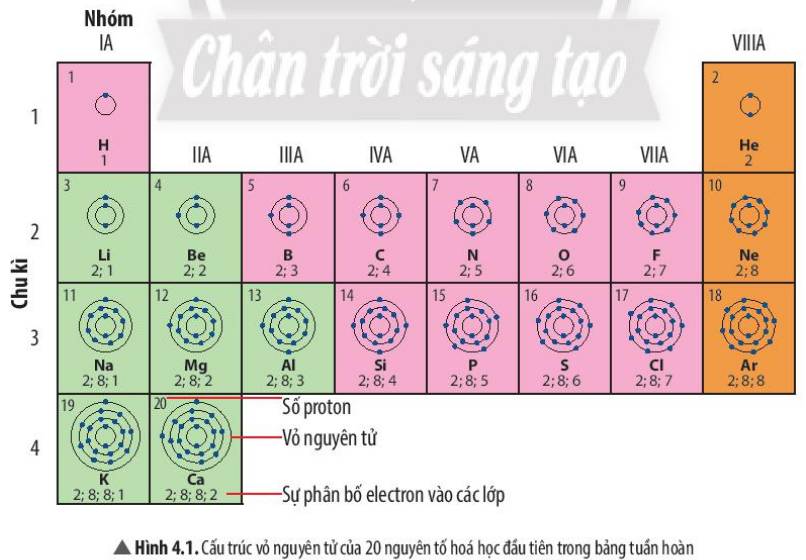
1. Nguyên tử nguyên tố H , nguyên tử nguyên tố He có 1 lớp e
Nguyên tử nguyên tố Li, Be, C, N có 2 lớp e.
2. STT chu kì của nguyên tử nguyên tố H, He (1) < STT chu kì của nguyên tử nguyên tố Li, Be, C, N (2)

1:
Nguyên tử Li, Na có cũng số electron ở lớp ngoài cùng
Nguyên tử F, Cl có cũng số electron ở lớp ngoài cùng
2: Số electron lớp ngoài cùng của nguyên tử các nguyên tố chính là số thứ tự nhóm của các nguyên tố

Cấu hình X: 1s22s22p1
=> X có 5e => STT ô thứ 5, chu kì 2, nhóm IIIA

Gọi p là số proton
Gọi n là số nơ tron
Gọi e là số electron
Theo đề bài ta có :
p+n+e=58 và p+n<40
Ta thấy p+n=39<40 (số khối hay Khối lượng nguyên tử) ⇒ n=58-39=19 electron (lớp 1 : 2 electron; lớp 2 : 8 electron; lớp 3: 8 electron; lớp 4 : 1 electron)
⇒ Nguyên tử đó có 4 lớp electron và lớp ngoài cùng có 1 electron ⇒ Thuộc chu kỳ 4 và Nhóm IA
Vậy nguyên tử đó là K (Protassium) và số hiệu nguyên tử là 19

`#3107.101107`
a.
Gọi số hạt proton, neutron, electron trong nguyên tử X lần lượt là `p, n, e`
Tổng số hạt trong nguyên tử X là `48`
`=> p + n + e = 48`
Mà trong nguyên tử, số `p = e`
`=> 2p + n = 48`
Mà số hạt `p = n`
`=> 3p = 48`
`=> p = 48 \div 3`
`=> p = 16`
Vậy, số `p = n = e = 16`
b.
Khối lượng nguyên tử X là: `16 + 16 = 32` (amu)
c.
Bạn tham khảo mô hình NT X:
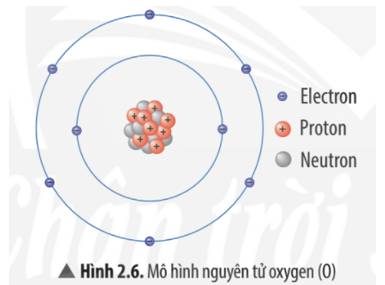
- X có `3` lớp electron
- X có `6` electron lớp ngoài cùng.

`1,`
Số electron lớp ngoài cùng của nguyên tử nguyên tố `Al` là `3`
Gt: Nguyên tố `Al` thuộc nhóm `IIIA`
Vì số nhóm `A` bằng số electron lớp ngoài cùng của các nguyên tử nguyên tố thuộc nhóm đó `-> Al` có `3e` lớp ngoài cùng.
Tương tự, `Cl` thuộc nhóm `VIIA ->` nguyên tố `Cl` có `7e` lớp ngoài cùng.
`2,`
Các nguyên tố thuộc chu kì và cùng nhóm với nguyên tố `Be:`
Chu kì: `Li, B, C, N, O, F, Ne`
Nhóm: `Mg, Ca, Sr, Ba, Ra`
1. Cấu hình e của Al (Z=13): 1s22s22p63s23p1
=> Có 3e lớp ngoài cùng (3e lớp thứ 3)
Cấu hình e của S (Z=16): 1s22s22p63s23p23p4
=> Có 6e lớp ngoài cùng (6e lớp thứ 3)

a)
1 lớp:H,He
2 lớp:Li, Be, B, C, N, O, F
3 lớp:Na, Mg, Al, Si, P, S, Cl, Ar
4 lớp:K,Ca
b)
1 e ngoài cùng:H, Li, Na, K
2 e ngoài cùng:Be, Mg, Ca
3 e ngoài cùng:B, Al
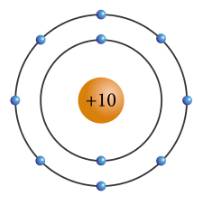
a: X có 10electron và có 2 lớp electron
b: X là neon
c: Oxy, Nitơ,cacbon