
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1. Gam
2. 6,022.10^23
3. Một
4.gam/mol
5. Trị số
6. Đơn vị đo
7. Phân tử khối
8. Khác nhau

1, -khí hidro+ khí oxi →nước
H2+O2 -----> H2O
- ko bằng nhau, vì : + bên phải có : 2H; 2O
+ bên trái có: 2H; 1O
=> 2 vế đó ko bằng nhau
2, Al+O2 ----> Al2O3
4Al + 3O2 →2Al2O3

1, chỉ cách làm mẫu nek:
NO+O2=>NO2
NO+O2 là vế 1, NO2 là vế 2
vế 1 : N=1, O=3
vế 2 : N=1, O=2
cân bằng:
vế 2: 2O2( O vế 2 ít ng tử hơn )
lúc này vế 2 có O=4 vàN=2
vế 1: 2NO
lúc này vế 1 N=2, O=4
kl : 2NO+O2=>2NO2
2 , làm y như nãy:
4P+5O2=>2P2O5
3, Fe2O3+3H2SO4=>Fe(SO4)3+3H2O



ta có A cùng thể tích với O2=> A có cùng số mol với O2
Va=22,4l=> VO2=22,4l=> nO2=1mol
=> m O2=32.1=32g
mà A nặng gấp 2 lần=> ma=32,2=64g
=> M A=m/n=64:1=64g/mol
vậy PTK A=64
gọi công thức A là : SxOy
=> MA=32x+16y=64
ta thấy x=1 và y=2 thỏa
=> Công thức của A là: SO2

bn viết đầu bài k rõ ràng nên k giúp dc,nếu k có số % thi moi dung,bn xem lại,mk lam cho
bạn làm hộ mình vs đề của minh cũng ko có %. Còn lại đề thì giống bạn Phạm Trịnh My chỉ khác là ko có %. Bạn làm hộ mình vs
 Giúp mình với mn ơi, mình đang cần gấp mà ko biết làm :((
Giúp mình với mn ơi, mình đang cần gấp mà ko biết làm :((
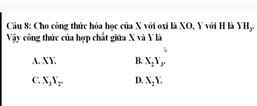
ghi đề ra jk pn
Sách KHTN hả bn ?