
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2}=\dfrac{1,12}{22,4}=0,05mol\)
\(2C_2H_5OH+2Na\rightarrow2C_2H_5ONa+H_2\)
0,1 0,05 ( mol )
\(m_{C_2H_5OH}=0,1.46=4,6g\)

- NaHCO3: Tạo ra khí CO2 tan ít trong nước--> Thỏa mãn
\(2NaHCO_3\underrightarrow{t^o}Na_2CO_3+CO_2+H_2O\)
- NH4Cl và CaO: Tạo ra khí NH3, HCl tan nhiều trong nước --> không thỏa mãn
\(NH_4Cl\underrightarrow{t^o}NH_3+HCl\)
- CH3COONa, NaOH, CaO: Tạo khí CH4 tan ít trong nước --> Thỏa mãn
\(CH_3COONa+NaOH\underrightarrow{t^o,CaO}CH_4+Na_2CO_3\)
- KMnO4: Tạo khí O2 tan ít trong nước --> Thỏa mãn
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)

1)
A là \(CH_2=CH-CH_2OH\)
B là \(CH_2=CH-CHO\)
C là \(CH_2=CH-COOH\)
PTHH:
\(2CH_2=CH-CH_2OH+2Na\rightarrow2CH_2=CH-CH_2ONa+H_2\)
\(2CH_2=CH-COOH+2Na\rightarrow2CH_2=CH-COONa+H_2\)
\(CH_2=CH-CH_2OH+H_2\underrightarrow{t^o,Ni}CH_3-CH_2-CH_2OH\)
\(CH_2=CH-CHO+2H_2\underrightarrow{t^o,Ni}CH_3-CH_2-CH_2OH\)
\(CH_2=CH-CH_2OH+CuO\underrightarrow{t^o}CH_2=CH-CHO+H_2O+Cu\)
2)
TN1:
- Hiện tượng: Sau 1 thời gian, màu vàng của clo nhạt dần. Cho nước vào bình, lắc nhẹ rồi thêm vào bình 1 mẩu giấy quỳ tím thấy giấy chuyển màu đỏ.
- Mục đích: Chứng minh metan pư với clo khi có ánh sáng
\(CH_4+Cl_2\underrightarrow{as}CH_3Cl+HCl\)
TN2:
- Hiện tượng: dd Br2 nhạt màu dần
- Mục đích: Chứng minh C2H2 pư với Br2
\(C_2H_2+Br_2\rightarrow C_2H_2Br_2\)
\(C_2H_2Br_2+Br_2\rightarrow C_2H_2Br_4\)
TN3:
- Hiện tượng: 2 chất lỏng tạo thành dd đồng nhất
- Mục đích: Chứng minh benzen có thể hòa tan dầu ăn
3)
- Có 3 đồng phân đơn chức mạch hở ứng với CTPT C3H6O2 là C2H5COOH, HCOOC2H5, CH3COOCH3
- C2H5COOH:
\(2CH_4\underrightarrow{1500^oC,làm.lạnh.nhanh}CH\equiv CH+3H_2\)
\(CH\equiv CH+H_2\underrightarrow{t^o,Pd/PbCO_3}CH_2=CH_2\)
\(CH_2=CH_2+HBr\rightarrow CH_3-CH_2Br\)
\(CH_3-CH_2Br+KCN\rightarrow CH_3-CH_2CN+KBr\)
\(CH_3-CH_2CN+2H_2O+H^+\underrightarrow{t^o}CH_3-CH_2-COOH+NH_4^+\)
- HCOOC2H5
\(CH_2=CH_2+H_2O\underrightarrow{t^o,H^+}CH_3-CH_2OH\)
\(CH_4+O_2\underrightarrow{t^o,xt}HCHO+H_2O\)
\(2HCHO+O_2\underrightarrow{t^o,xt}2HCOOH\)
\(HCOOH+CH_3-CH_2OH\underrightarrow{t^o,H^+}HCOOCH_2-CH_3+H_2O\)
- CH3COOCH3
\(C_2H_5OH+O_2\underrightarrow{men.giấm}CH_3COOH+H_2O\)
\(CH_4+Cl_2\underrightarrow{as}CH_3Cl+HCl\)
\(CH_3Cl+NaOH\rightarrow CH_3OH+NaCl\)
\(CH_3COOH+CH_3OH\underrightarrow{t^o,H^+}CH_3COOCH_3+H_2O\)
4)
- Trích một ít các chất làm mẫu thử, hòa tan các chất vào nước:
+ Chất lỏng tan, tạo thành thể đồng nhất: C2H5COOH
+ Chất lỏng không tan, tách thành 2 lớp: HCOOC2H5, CH3COOCH3 (1)
- Cho các chất ở (1) tác dụng với dd AgNO3/NH3, đun nóng:
+ Xuất hiện kết tủa trắng xám bám vào ống nghiệm: HCOOC2H5
\(HCOOC_2H_5+2AgNO_3+3NH_3+H_2O\underrightarrow{t^o}2Ag+2NH_4NO_3+NH_4OCOOC_2H_5\)
+ Không hiện tượng: CH3COOCH3


a)
(1) S + H2 --to--> H2S
(2) S + O2 --to--> SO2
(3) Fe + S --to--> FeS
b)
(4) Zn + Cl2 --to--> ZnCl2
(5) 2Fe + 3Cl2 --to--> 2FeCl3
(6) H2 + Cl2 --to--> 2HCl


a)
\(Cu + 2H_2SO_4 đ \rightarrow^{t^o} CuSO_4 + SO_2 + 2H_2O\)
\(CuSO_4 + BaCl_2 \rightarrow CuCl_2 + BaSO_4\)
\(CuCl_2 + 2NaOH \rightarrow Cu(OH)_2 + 2NaCl\)
\(Cu(OH)_2 \rightarrow^{t^o} CuO + H_2O\)
\(CuO + 2HCl \rightarrow CuCl_2 + H_2O\)
\(CuCl_2 + Fe \rightarrow Cu + FeCl_2\)
b)
\(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\)
\(AlCl_3 + 3NaOH_{vừa đủ/thiếu} \rightarrow Al(OH)_3 + 3NaCl\)
\(2Al(OH)_3 \rightarrow^{t^o} Al_2O_3 + 3H_2O\)
\(2Al_2O_3 \rightarrow^{đpnc} 4Al + 3O_2\)
\(2Al + 3H_2SO_4 \rightarrow Al_2(SO_4)_3 + 3H_2\)
\(Al_2(SO_4)_3 + 6NaOH_{vừa đủ/ thiếu} \rightarrow 2Al(OH)_3 + 3Na_2SO_4\)
\(Al(OH)_3 + 3HCl \rightarrow AlCl_3 + 3H_2O\)
c)
\(Fe + H_2SO_4 \rightarrow FeSO_4 + H_2\)
\(FeSO_4 + BaCl_2 \rightarrow BaSO_4 + FeCl_2\)
\(FeCl_2 + 2NaOH \rightarrow Fe(OH)_2 + 2NaCl\)
\(Fe(OH)_2 \rightarrow^{t^o} FeO + H_2O\)
\(FeO + H_{2_{dư}} \rightarrow^{t^o} Fe + H_2O\)
\(Fe + 2HCl \rightarrow FeCl_2 + H_2\)
\(Mg + FeCl_2 \rightarrow MgCl_2 + Fe\)
\(3Fe + 2O_2 \rightarrow^{t^o} Fe_3O_4\)


| KHHH | Tên NT | NTK | STT | Chu kì | Nhóm | Số p | Số e | Điện tích hạt nhân |
| Si | Silic | 28 đvC | 14 | 3 | IVA | 14 | 14 | 14+ |
| P | Photpho | 31 đvC | 15 | 3 | VA | 15 | 15 | 15+ |
| K | Kali | 39 đvC | 19 | 4 | IA | 19 | 19 | 19+ |
| Ca | Canxi | 40 đvC | 20 | 4 | IIA | 20 | 20 | 20+ |

Bài 1:
c) (1) S+ O2 -> SO2
(2) SO2 + 2 NaOH -> Na2SO3 + H2O
(3) SO2 + 1/2 O2 \(⇌\left(to,xt\right)\) SO3
(4) SO3 + H2O -> H2SO4
(5) H2SO4 + 2 NaOH -> Na2SO4 +2 H2O
(6) Na2SO4 + BaCl2 -> BaSO4 + 2 NaCl
(7) SO3 ra chất gì mũi tên xuống?
(8) SO2 + H2O \(⇌\) H2SO3
(9) H2SO3+ Na2SO4 -> H2SO4 + Na2SO3
(10) Na2SO3+ H2SO4 -> Na2SO4 + SO2 + H2O
Bài 1:
a) (1) CaCO3 + Ba(OH)2 -> BaCO3 + Ca(OH)2
(2) CaCO3 -to-> CaO + CO2
(3) CaCO3 ra CaCO3?
(4) CaO + 2 HCl -> CaCl2 + H2O
 Mn giúp m vs
Mn giúp m vs Mk đang cần gấp, mn giúp mình vs ạ
Mk đang cần gấp, mn giúp mình vs ạ



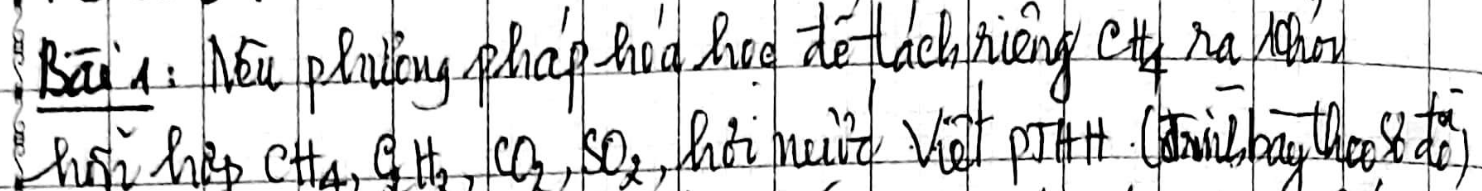





Một hợp chất khí, phân tử có 85,7% C về khối lượng, còn lại là H. Phân tử khối của hợp chất là 28. Tìm số nguyên tử của mỗi nguyên tố trong 1 phân tử hợp chất.