Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n C u S O 4 = 0,525.0,2 = 0,105 m o l
Vì thu được kết tủa là 2 kim loại nên Fe còn dư.
Suy ra, kết tủa là Fe dư và C u , C u S O 4 phản ứng hết.
Gọi a, b, c là số mol của Al phản ứng, Fe phản ứng và Fe dư.
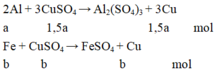
Từ phương trình phản ứng và dữ kiện đề bài cho, ta lập được hệ phương trình:
3 2 a + b = n C u S O 4 a .27 + b .56 + c .56 = m K L 3 2 a .64 + b .64 + c .56 = m k e t t u a ⇔ 3 2 a + b = 0,105 27 a + 56 b + 56 c = 4,15 96 a + 64 b + 56 c = 7,84
⇔ a = 0,05 b = 0,03 c = 0,02
Vậy n A l = 0 , 05 m o l ; n F e b đ = b + c = 0 , 05 m o l .
Đáp án C

Kết tủa A gồm 2 kim loại là Cu và Fe dư → CuSO4 và Al phản ứng hết.
n(CuSO4) = 0,525.0,2 = 0,105mol
Theo ĐL bảo toàn nguyên tố: n(Cu) = n(CuSO4) = 0,105mol
Khối lượng Fe dư:
m(Fe dư) = m(A) - m(Cu) = 7,84 - 0,105.64 = 1,12g
Gọi x, y là số mol Al và Fe tham gia pư:
m(hh KL) = m(Al) + m(Fe pư) + m(Fe dư) = 27x + 56y + 1,12 = 4,15g
Cho hh kim loại vài dung dịch CuSO4
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
x 3x/2
Fe + CuSO4 → FeSO4 + Cu
y y
n(CuSO4) = 3x/2 + y = 0,105mol
→ x = 0,05mol và y = 0,03mol
Khối lượng mỗi kim loại:
m(Al) = 0,05.27 = 1,35g
m(Fe) = m(Fe pư) + m(Fe dư) = 56.0,03 + 1,12 = 2,8g
A chứa 2 kim loại là Cu và Fe dư →Al phản ứng hết,Fe phản ứng một phần ,Cu2 bị khử hết
Đặt a,b,c là số mol Al , Fe phản ứng và Fe dư
→ 27a + 56(b+c) = 4,15
bảo toàn electron → 3a + 2b = 0,105.2
mA= 56c + 0,105.64 = 7,84
Giả hệ → a=0,05 ; b=0,03 ; c=0,02
A gồm Cu (0,105)và Fe dư(0,02)
bảo toàn electron: 2ncu + 3nFe dư = 3nNO
→ nNO = 0,09
→ nHNO3 = 4nNO = 0,36 mol
→ V=180ml

Bắt đầu xuất hiện kết tủa nghĩa là: NaOH đầu tiên sẽ trung hòa HCl dư trước
NaOH + HCldư → NaCl + H2O
0,2 ←0,2
→ 2V1 = 0,2 → V1 = 0,1
Đến khi kết tủa không thay đổi khối lượng thì khi đó kết tủa bị hòa tan hết.
3NaOH + AlCl3 → 3NaCl + Al(OH)3↓
3x ←x → x
NaOH + Al(OH)3 → NaAlO2 + 2H2O
x ←x
→ 0,2 + 4x = 0,6.2 → x = 0,25
=> y = 0,025
=> m = 17,75g

Gọi a, b là số mol Mg, Fe phản ứng.
Mg+CuSO4→MgSO4+Cu
a_____a_______a____a
Fe+CuSO4→FeSO4+Cu
b____b_______b_____b
(Nếu giải ra b>0 thì Fe đã phản ứng. Nếu giải ra b=0 thì Fe chưa phản ứng)
MgSO4+2NaOH→Mg(OH)2+Na2SO4
a________________a
FeSO4+2NaOH→Fe(OH)2+Na2SO4
b________________b
Mg(OH)2→MgO+H2O
a_________a
4Fe(OH)2+O2→2Fe2O3+4H2O
b_____________\(\dfrac{b}{2}\)
5,1-24a-56b+64(a+b)=6,9
=> \(\left\{{}\begin{matrix}\text{5a+b=0,225
}\\40a+160\dfrac{b}{2}=4,5\end{matrix}\right.\)Giải hệ, được a=b=0,0375
%mMg=24.0,0375/5,1.100%=17,65%
%mFe=100%-17,65%=82,35%
Số mol Fe có trong A bằng\(\dfrac{\text{(5,1-24.0,0375)}}{56}\)=0,075(mol)
Fe dư và CuSO4 phản ứng hết.
nCuSO4=a+b=0,0375+0,0375=0,075(mol)
CM(CuSO4) =0,075/0,25=0,3(M)
a) Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) => 24a + 56b = 5,1 (1)
- Nếu Fe tan hết:
Bảo toàn Mg: nMgO = a (mol)
Bảo toàn Fe: \(n_{Fe_2O_3}=0,5b\left(mol\right)\)
=> 40a + 160.0,5b = 4,5
=> 40a + 80b = 4,5 (2)
(1)(2) => Nghiệm âm (vô lí)
=> Trong X có Fe
Gọi nFe(pư) = x (mol)
PTHH: Mg + CuSO4 --> MgSO4 + Cu
a---->a------------------->a
Fe + CuSO4 --> FeSO4 + Cu
y---->y------------------->y
=> 64(a + y) + 56(b - y) = 6,9
=> 64a + 56b + 8y = 6,9 (3)
Bảo toàn Mg: nMgO = a (mol)
Bảo toàn Fe: nFe2O3 = 0,5y (mol)
=> 40a + 80y = 4,5 (4)
(1)(3)(4) => \(\left\{{}\begin{matrix}a=0,0375\left(mol\right)\\b=0,075\left(mol\right)\\y=0,0375\left(mol\right)\end{matrix}\right.\)
\(\%m_{Mg}=\dfrac{0,0375.24}{5,1}.100\%=17,647\%\)
b) \(n_{CuSO_4}=a+y=0,075\left(mol\right)\)
=> \(C_{M\left(CuSO_4\right)}=\dfrac{0,075}{0,25}=0,3M\)
c) X gồm \(\left\{{}\begin{matrix}Cu:0,075\left(mol\right)\\Fe:0,0375\left(mol\right)\end{matrix}\right.\)
PTHH: Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
=> \(n_{SO_2}=0,13125\left(mol\right)\)
=> \(V_{SO_2}=0,13125.22,4=2,94\left(l\right)\)
Theo đề bài ta có : nCuSO4 = 0,2.0,525 = 0,105 (mol)
Ta có PTHH:
\(Fe+C\text{uS}O4->FeSO4+Cu\)
\(2Al+3CuSO4->Al2\left(SO4\right)3+3Cu\)
Theo 2 PTHH ta có : nCu = nCuSO4 = 0,105 (mol)
Ta có : mA = mFe(dư) + mCu(thu được) => mFe(dư) = 7,84-0,105.64 = 1,12(g) => nFe(dư) = \(\dfrac{1,12}{56}=0,02\left(mol\right)\)
PTHH :
\(Fe+4HNO3->Fe\left(NO3\right)3+NO\uparrow+2H2O\)
0,02mol...0,08mol
\(3Cu+8HNO3->3Cu\left(NO3\right)2+2NO\uparrow+4H2O\)
0,105mol..0,28mol
=> CMddHNO3 = \(\dfrac{\left(0,08+0,28\right)}{2}=0,18\left(l\right)\)
Vậy...