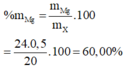Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




1. Điện tích tuyệt đối Điện tích tuyệt đối nghĩa là giá trị thực của điện tích mà từng hạt mang (tính theo coulomb hoặc theo đơn vị điện tích cơ bản e = 1,602 × 10⁻¹⁹ C). Proton: mang điện tích +e = +1,602 × 10⁻¹⁹ C Electron: mang điện tích –e = –1,602 × 10⁻¹⁹ C Neutron: không mang điện tích ⇒ 0 C 👉 Điện tích tuyệt đối của proton và electron là như nhau về độ lớn, khác dấu. --- 2. Điện tích tương đối Trong vật lý hạt nhân hay hóa học, người ta hay quy ước điện tích tương đối theo đơn vị e (đơn vị điện tích cơ bản). Proton: +1 Electron: –1 Neutron: 0 👉 Điện tích tương đối chỉ cho biết "so với e thì hạt đó bằng bao nhiêu". --- 3. Điện tích hạt nhân (nếu mày hỏi thêm về toàn bộ hạt nhân) Nếu hạt nhân có Z proton và N neutron thì: Điện tích tuyệt đối của hạt nhân = Z × e (Coulomb) Điện tích tương đối của hạt nhân = Z (đơn vị e) Còn neutron không góp phần vào điện tích hạt nhân, chỉ góp khối lượng. ---
1. Điện tích tuyệt đối
- Điện tích tuyệt đối là giá trị điện tích thực tế theo Coulomb (C).
- Ký hiệu: \(q\)
- Giá trị của các hạt cơ bản:
| Hạt | Điện tích tuyệt đối \(q\) |
|-----|--------------------------|
| Proton | \(+ 1 , 602 \times 10^{- 19} \textrm{ } C\) |
| Neutron | \(0 \textrm{ } C\) (không mang điện) |
| Electron | \(- 1 , 602 \times 10^{- 19} \textrm{ } C\) |
Lưu ý: Proton mang điện dương, electron mang điện âm, neutron trung hòa.
2. Điện tích tương đối (đơn vị điện tích nguyên tử)
- Điện tích tương đối là điện tích của hạt tính theo đơn vị điện tích proton (đơn vị e).
- Ký hiệu: \(Z\) hoặc \(e\)
- Giá trị:
| Hạt | Điện tích tương đối |
|-----|-------------------|
| Proton | \(+ 1\) |
| Neutron | \(0\) |
| Electron | \(- 1\) |
3. Ghi nhớ nhanh
- Proton: \(+ 1\) e, \(+ 1 , 602 \cdot 10^{- 19} \textrm{ } C\)
- Neutron: 0 e, 0 C
- Electron: \(- 1\) e, \(- 1 , 602 \cdot 10^{- 19} \textrm{ } C\)

Chọn đáp án D
Muối của một kim loại với nhiều loại gốc axit khác nhau gọi là muối hỗn tạp
→ Clorua vôi là muối hỗn tạp.

\(6FeSO_4+3Cl_2\underrightarrow{t^o}2Fe_2\left(SO_4\right)_3+2FeCl_3\)

Gọi công thức chung là M
\(\text{2M+2H2O-->2MOH+H2}\)
\(MOH+H^+\rightarrow M^++H2O\)
Ta có :
\(\text{nHCL=0.05 nH2SO4=0.025}\)
--->nH+=0.1
--->nMOH=nM=0.1
-->M=3.1/0.1=31
--->A là Na23 B là K39
Đặt số mol Na và K là a và b
\(\left\{{}\begin{matrix}\text{a+b=0.1}\\\text{23a+39b=3.1}\end{matrix}\right.\Rightarrow a=b=0,05\)
\(\text{%mNa=0.05*23/3.1=37.1%}\)
\(\text{%mK=62.9%}\)

1.Chất là phạm trù triết học dùng để chỉ tính quy định khách quan vốn có của sự vật, hiện tượng, đó là sự thống nhất hữu cơ của những thuộc tính, những yếu tố cấu thành sự vật, hiện tượng, nói lên sự vật, hiện tượng đó là gì, phân biệt nó với các sự vật, hiện tượng khác.
3.Nguyên tử là đơn vị cơ bản của vật chất và xác định cấu trúc của các nguyên tố. Nguyên tử được cấu tạo từ ba loại hạt: proton, neutron, và electron. Proton và neutron thì nặng hơn electron và cư trú trong tâm của nguyên tử, nơi được gọi là hạt nhân.