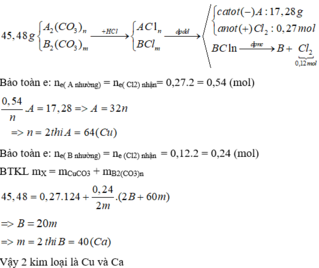Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
- Khí bắt đầu thoát ra ở catot là khi Fe3+, Cu2+ bị điện phân hết, H+ vừa bị điện phân
Phương trình điện phân:
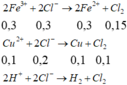
- Thêm dung dịch AgNO3 vừa đủ vào
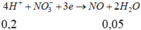
=> m Y =200+250-156,65-30.0,05-71.0,25=274,1 g
- Dung dịch Y Chứa 2 muối là: Fe(NO3)3 ; Cu(NO3)2
Muối có phân tử khối lớn hơn là Fe(NO3)3
C % Fe ( NO 3 ) 3 = 242 . 0 , 3 274 , 1 . 100 % = 26 , 49 % gần với giá trị 27 phút

Giải thích: Đáp án C
+ Bình 1: nNaOH=0,0346 mol
Sau khi x mol H2O bị điện phân thì thể tích dung dịch còn lại là 20-18x (ml)
=> CM=0,0346/[(20-18x)/1000] = 2
=> x=0,15
=> ne = 2x = 0,3
Bình 2:
Tại catot:
Cu2+ +2e → Cu
0,15.....0,3
Cu2+ dư 0,225-0,15=0,075 mol
Tại anot:
Cl- -1e → 0,5 Cl2
0,2→0,2
H2O – 2e → 0,5O2 + 2H+
0,1 → 0,1
Dung dịch trong bình 2 sau điện phân gồm: 0,075 mol Cu2+; H+: 0,2+0,1=0,3 mol
Khi cho 0,25 mol Fe vào:
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
Bđ: 0,25 0,3 0,45
Pư: 0,1125← 0,3 →0,075
Sau: 0,1375
Fe + Cu2+ → Fe2+ + Cu
Bđ:0,1375 0,075
Pư:0,075 ← 0,075 →0,075
Sau:0,0625 0,075
=> m chất rắn = 0,0625.56+0,075.64=8,3 gam

Đáp án D
Ta có: mắc nối tiếp nên hai bình điện phân cùng I.
• bình 1: giải điện phân NaOH → có thể coi là quá trình điện phân H2O
từ CM (NaOH) → nH2O bị điện phân = 0,15 mol ⇄ ne trao đổi = 0,3 mol.
• dùng giả thiết ne trao đổi trên: có điện phân bình 2 ra: 0,1 mol CuCl2 + 0,05 mol CuO.
||→ bảo toàn gốc NO3 đọc ra dd sau điện phân gồm 0,075 mol Cu(NO3)2 và 0,3 mol HNO3.
Quy về giải 0,25 mol Fe + 0,075 mol Cu(NO3)2 + 0,3 mol HNO3 → ? gam chất rắn không tan.!
Giải: m gam chất rắn gồm 0,075 mol Cu và 0,0625 mol Fe ⇄ m = 8,3 gam.

Đáp án D
Ở đây có dùng một kiến thức vật lí:
mắc nối tiếp nên hai bình điện phân cùng I.
• bình (1): giải điện phân NaOH
→ có thể coi là quá trình điện phân H2O
từ CM (NaOH) → nH2O bị điện phân = 0,15 mol ⇄ ne trao đổi = 0,3 mol.
• dùng giả thiết ne trao đổi trên: có điện phân bình (2) ra:
0,1 mol CuCl2 + 0,05 mol CuO.
||→ bảo toàn gốc NO3 đọc ra dd sau điện phân gồm 0,075 mol Cu(NO3)2 và 0,3 mol HNO3.
Quy về giải 0,25 mol Fe + 0,075 mol Cu(NO3)2 + 0,3 mol HNO3
→ ? gam chất rắn không tan.!
Giải: m gam chất rắn gồm 0,075 mol Cu và 0,0625 mol Fe ⇄ m = 8,3 gam.

Đáp án B
Vì hai bình điện phân mắc nối tiếp nên số mol electron trao đổi ở hai bình điện phân là như nhau.
Ở hai bình đều không thấy khí ở catot thoát ra nên ở catot của hai bình chưa có sự điện phân nước.
Áp dụng định luật bảo toàn mol electron, ta có:
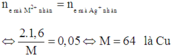

Đáp án B
Do hai bình mắc nối tiếp điện tích qua chúng không đổi, dẫn tới số mol e trao đổi của chúng bằng nhau:
![]()

Đáp án C

- Sau điện phân:
+ Thể tích dung dịch NaOH ở bình 1 = 0 , 0692 2 =0,03461=34,6 ml
=> Thể tích nước bị điện phân = 40 - 34,6 = 5,4 ml
=> Số mol nước bị điện phân ở bình 1 = 5 , 4 18 = 0,3 mol
+ Bình 2:
n Cu = n H 2 O điện phân ( I ) = 0 , 3 mol ⇒ n Cu 2 + dư = 0 , 45 - 0 , 3 = 0 , 15 mol n Cl 2 = 1 2 n Cl - = 0 , 2 mol ⇒ n H 2 O điện phân ( 1 ) = 0 , 3 - 0 , 2 = 0 , 1 mol ⇒ n H + = 0 , 2 + 0 , 4 = 0 , 6 mol
- Cho 0,5 mol Fe vào dung dịch bình 2 sau phản ứng điện phân
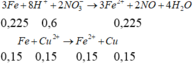
=> m = 56.(0,5-0,225-0,15)+64.0,15=16,6 gam gần với giá trị 17 nhất