Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Vì hai bình điện phân mắc nối tiếp nên số mol electron trao đổi ở hai bình điện phân là như nhau.
Ở hai bình đều không thấy khí ở catot thoát ra nên ở catot của hai bình chưa có sự điện phân nước.
Áp dụng định luật bảo toàn mol electron, ta có:
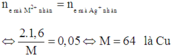

Đáp án B
Do hai bình mắc nối tiếp điện tích qua chúng không đổi, dẫn tới số mol e trao đổi của chúng bằng nhau:
![]()

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Vi la KL kiem nen PU la : RCl ---> R + 1/2 Cl2 , ncl2 =0.08 mol => n kl = 2*0.08= 0.16mol
M(kimloai) = 6.24/ 0.16 = 39 => kimloai la Kali Chon C


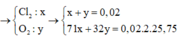
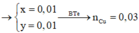
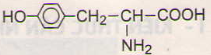 với các chất sau:
với các chất sau:
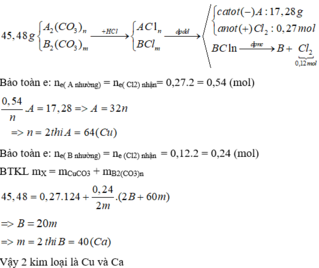
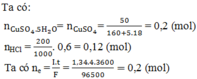


Đáp án A
- 2 bình mắc nối tiếp nên dòng điện chạy qua có cùng cường độ
Đổi 3 phút 13 giây = 193 giây; 9 phút 39 giây = 579 giây
- Phương trình điện phân
Bình 1:
Bình 2:
+ Bình 2:
=> Chứng tỏ Ag+ còn dư sau khi điện phân 193s, có thể còn dư sau điện phân 579s
Điện phân 193s :
+ Bình 1:
=> Chứng tỏ M2+ ở bình 1 bị điện phân trước, sau khi điện phân 193s thì M2+ còn dư; sau khi điện phân 579s thì M2+ hết; H+ đã bị điện phân
Điện phân 193s:
=> M là Cu => 0,8 a = 3 , 2 64 => a = 0,0625(M)