Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Hàm lượng N trong NH4Cl là:
\(\%N=\dfrac{14}{14+4+35,5}\times100\%=26,17\%\)
Hàm lượng N trong (NH4)2SO4 là:
\(\dfrac{14\times2}{2\times\left(14+4\right)+32+16\times4}\times100\%=10,61\%\)

a) Tên hóa học của phân bón:

b) Nhóm phân bón dạng đơn: KCl, NH4NO3, NH4Cl, (NH4)2SO4, Ca3(PO4)2, Ca(H2PO4)2.
Nhóm phân bón dạng kép: NH4H2PO4, KNO3.
c) Để có phân bón kép NPK ta trộn các phan bón MH4NO3, NH4H2PO4 và KCl theo tỉ lệ thích hợp.
a) Tên hóa học của phân bón: KCl: Kali clorua; NH4NO3: Amoni nitrat; NH4Cl: Amoni clorua; (NH4)2SO4: Amoni sunphat; Ca3(PO4)2: Canxi photphat; Ca(H2PO4)2: Canxi đihiđrophotphat; (NH4)2HPO4: Điamoni hiđrophotphat; KNO3: Kali nitrat.
b) Hai nhóm phân bón:
– Phân bón đơn: KCl, NH4NO3, NH4Cl, (NH4)2SO4, Ca3(PO4)2, Ca(H2PO4)2.
– Phân bón kép: (NH4)2HPO4, KNO3.
c) Phân bón kép NPK: Trộn các phân bón NH4NO3, (NH4)2HPO4 và KCl theo tỉ lệ thích hợp, được phân bón NPK.

Chọn D
(1) Sai :(N H 4 ) 2 S O 4 chứa nguyên tố N nên dùng để cung cấp phân đạm cho cây, không chứa Photpho → không dùng để cung cấp phân lân
(2) Đúng: Phần trăm khối lượng N có trong phân hóa học là:
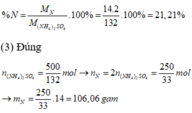
(4) Sai vì phân này tan hoàn toàn trong nước
(5) Sai vì phân ure (N H 2 ) 2 CO có hàm lượng N cao hơn phân (N H 4 ) 2 S O 4
→ thay ure bằng phân này sẽ giảm hàm lượng nguyên tố dinh dưỡng
→ ít lợi hơn
Vậy có 2 phát biểu đúng

nZn = 0,3 mol
Zn + Cl2 \(\underrightarrow{t^o}\) ZnCl2
\(\Rightarrow\) VCl2 = 0,3.22,4 = 6,72 (l)
MnO2 + 4HCl \(\underrightarrow{t^o}\) MnCl2 + Cl2 + 2H2O
\(\Rightarrow\) mMnCl2 = 0,3.126 = 37,8 (g)
a) PTHH xảy ra: Zn + Cl2→ ZnCl2
b) số mol Zn tham gia phản ứng : nZn=\(\dfrac{19,5}{65}\)=0,3(mol)
PTHH: Zn+ Cl2→ZnCl2
Theo phương trình (mol ) : 1 1 1
Theo đề (mol) : 0,3 ⇒0,3
Thể tích Cl2 cần dùng cho phản ứng :
VO2=0,3.22,4=6,72(lít)
Mong chị thông cảm vì em mới học lớp 7 , nên câu c em chưa biết làm ạ .

Câu 4:
\(n_{H_2SO_4}=\dfrac{200.19,6}{98.100}=0,4mol\)
\(n_{BaCl_2}=\dfrac{50.25}{208.100}\approx0,06mol\)
H2SO4+BaCl2\(\rightarrow\)BaSO4\(\downarrow\)+2HCl
-Tỉ lệ: \(\dfrac{0,4}{1}>\dfrac{0,06}{1}\rightarrow H_2SO_4dư\)
\(n_{H_2SO_4\left(pu\right)}=n_{BaSO_4}=n_{BaCl_2}=0,06mol\)
\(m_{BaSO_4}=0,06.233=13,98gam\)
\(n_{HCl}=2n_{BaCl_2}=2.0,06=0,12mol\)
\(n_{H_2SO_4\left(dư\right)}=0,4-0,06=0,34mol\)
\(m_{dd}=200+50-13,98=236,02gam\)
C%HCl=\(\dfrac{0,12.36,5}{236,02}.100\approx1,9\%\)
C%H2SO4=\(\dfrac{0,34.98}{236,02}.100\approx14,12\%\)
Câu 1:\(\%O=\dfrac{48}{2R+48}.100=47\rightarrow\)(2R+48).47=4800
\(\rightarrow\)94R+2256=4800\(\rightarrow\)94R=2544\(\rightarrow\)R=27(Al)
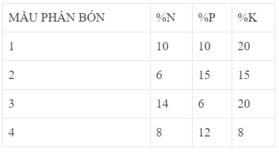
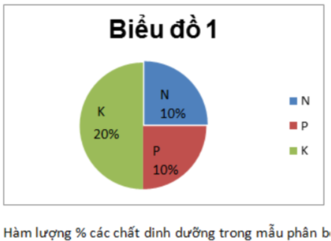
a) Để cung cấp 60kg N trong 1Ha đất
\(\rightarrow\) m phân bóng =\(\frac{mN}{\text{hàm lượng}}\)=\(\frac{60}{25\%}\)=240kg
b) Trong 100 kg phân bón
\(\rightarrow\)\(\text{mN=100.25%=25 kg}\)
\(\rightarrow\)nN=\(\frac{25}{14}\) kmol
\(\rightarrow\)nN=nNH4Cl=\(\frac{25}{14}\) k mol \(\rightarrow\) mNH4Cl=\(\frac{25}{14}\) . (18+35,5)=95,53kg
\(\rightarrow\) %NH4Cl=\(\frac{95,53}{100}\)=95,53%