Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có:
![]()

Ta có: → mdd tăng = mZn phản ứng - mFe sinh ra
9,6 = 0,12 + x).65 - 56.x → x = 0,2
Vậy: mZn = (0,12 + 0,2).56 = 20,8 (g)

Đáp án B
Ta có:
![]()
mCu = 0,7m (g)
Vì Fe phản ứng trước Cu và sau khi phản ứng còn 0,75m (g) chất rắn → Cu chưa phản ứng 0,7m
Fe dư 0,75m - 0,7m = 0,05m → mFe pư = 0,2m - 0,05m = 0,25m (g)
Fe dư → Chỉ tạo muối Fe(NO3)2
HNO3 hết (Lưu ý chỉ H+ hết, NO3- còn trong muối).
Quá trình nhường electron:

Quá trình nhận electron:
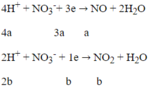
Áp dụng định luật bảo toàn electron:
![]()
→ m = 50,4

Đáp án D
Khối lượng Fe = 0,3m gam và khối lượng Cu = 0,7m gam
Sau phản ứng còn 0,75m gam → Fe chỉ phản ứng 0,25m gam; Fe dư vậy sau phản ứng chỉ thu được muối Fe2+.
Ta có:
![]()
Số mol của Fe(NO3)2 = 0,25m/56
Sơ đồ phản ứng:
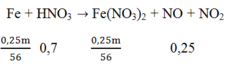
Áp dụng ĐLBT nguyên tố N ta có:
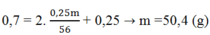

Đáp án B
Zn có tính khử mạnh hơn Fe, Zn sẽ phản ứng với dung dịch CuSO4 trước.
Theo đề: hỗn hợp rắn Z phản ứng với dung dịch H2SO4 loãng thu được 1 muối duy nhất → trong hỗn hợp rắn Z có Cu và Fe dư. Vậy mFe dư = 0,28 (g) và mCu = 2,84 - 0,28 = 2,56 (g)
Ta có: khối lượng hỗn hợp X phản ứng với Cu2+ = 2,7 - 0,28 = 2,42 (g)
Gọi nZn = x mol; nFe pư = y mol
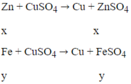
Ta có hệ:
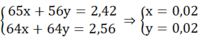
mFe ban đầu = 0,02.56 + 0,28 = 1,4 (g)
![]()

Ở 100°C là nhiệt độ cao bắt buộc ra KClO3
nCl2=0,6 mol
nKCl=0,5 mol
3Cl2 +6KOH =>5KCl + KClO3 +3H2O
0,6 mol
0,3 mol <=0,6 mol 0,5 mol
Dư 0,3 mol
CM dd KOH=0,6/2,5=0,24M
=>Chon A!!!!

Đáp án A
Số mol CuSO4 ban đầu là 0,2 mol
Gọi a là số mol Fe phản ứng:
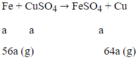
Khối lượng định sắt tăng lên là: 64a - 56a = 8a
Ta có: 8a = 0,4 → a = 0,05 mol
Số mol CuSO4 dư = 0,2 - 0,05 = 0,15 mol → [CuSO4]= 0,75M

Đáp án B
Ta có:
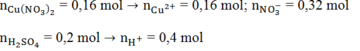
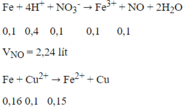
Do Fe nên tiếp tục xảy ra phản ứng:

nFe phản ứng = 0,1 + 0,05 + 0,16 = 0,31 mol
0,6m (g) hỗn hợp bột kim loại sau phản ứng gồm Fe dư và Cu sinh ra:
m - mFe pư + mCu = 0,6m → m - 0,31.56+ 64.0,16 = 0,6m
m = 17,8 (g)
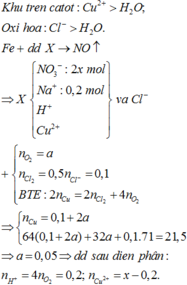
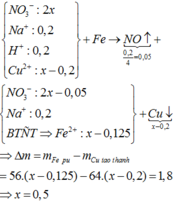

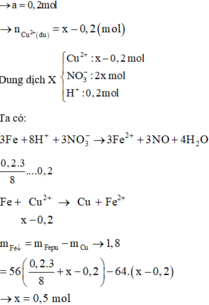
Đáp án C
Phương trình phản ứng:
Khối lượng thanh thứ nhất tăng 151%:
108an - aM = 1,51 (1)
Khối lượng thanh thứ 2 giảm:
aM - 32an = 0,01 (2)
Tổ hợp (1) và (2) ta được: aM = 0,65; an = 0,02
⇒ Chọn M = 32,5n
Khi n = 2 thì M = 65
Vậy M =Zn