Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2 A l + 3 H 2 S O 4 → A l 2 S O 4 3 + 3 H 2
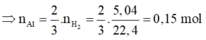
⇒ m F e 2 O 3 (bđ) = 20,05 - 0,15.27 = 16g
⇒ n F e 2 O 3 (bđ) = 16/160 = 0,1 mol
2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Bđ: 015 0,1
Pư: 0,15 0,065
Dư: 0 0,025
⇒ m F e 2 O 3 (dư) = 0,025.160=4g
⇒ Chọn A.

a.
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
nAl (dư, trong ½ phần) = 2/3.nH2 = 2/3.8,96/22,4 = 4/15 mol
nH2 = 26,88/22,4 = 1,2 mol
2Al + 6HCl = 3H2 + 2AlCl3
4/15..............0,4 mol
Fe + 2HCl = H2 + FeCl2
0,8..............0,8 mol
Phần không tan chỉ gồm Fe
Ta có : mFe = 44,8%m1 => m1 = m2 = 0,8.56.100/44,8 = 100g
b.
nFe (trong cả 2 phần) = 0,8.2 = 1,6 mol
2Al + Fe2O3 = Al2O3 + 2Fe
1,6....0,8.........0,8.........1,6 mol
=> mFe2O3 (ban đầu) = 0,8.160 = 128g
nAl (ban đầu) = nAl (ph.ư) + nAl (dư, trong 2 phần) = 1,6 + 2.4/15 = 32/15 mol
=> mAl (ban đầu) = 27.32/15 = 57,6g
sai rồi bạn ơi . 2 phần này có bằng nhau đâu mà làm theo kiểu v @@

cho anh hỏi nha: khi phản ứng nhiệt nhôm:
Fe2O3 + 2 Al → 2 Fe + Al2O3
cho hỗn hợp pư với NaOH:
Al2O3 + 2NaOH = H2O + 2NaAlO2
nên không có H2 đâu em!!!

Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g

nH2=0.56:22,4=0,025 mol
Fe+H2SO4----->FeSO4+H2
2AL+3H2SO4----->AL2(SO4)3 +3H2
Gọi x,y làn lượt là số mol Fe và AL
ta có hệ pt
\(\begin{cases}56x+27y=0,83\\x+1,5y=0,025\end{cases}\)
\(\begin{cases}x=0,01mol\\y=0,01mol\end{cases}\)
mFe=0,01.56=0,56 g
mAl=0,83-0,56=0,27 g
%mFe=(0,56:0,83).100=67,47%
%mAl=100-67,47=32,53%

n Al = 0,4 mol, n fe2o3 = 0,15 mol
\(\text{Fe2O3 +2 Al ---> Al2O3 + Fe2}\)
\(\text{nAl/2 < nFe2O3/1}\)
---> Nếu pứ hoàn toàn thì Fe2O3 hết trc
--> Hiệu suất sẽ tính theo fe2o3
vì pứ ko hoàn toàn, hh sau pứ còn pứ vs NaOH sinh ra H2 --> hh có Al
\(\text{Al + NaOH + H2O ---> NaAlO2 +3/2 H2}\)
\(\text{n H2 = 0,24 mol}\)
--> n Al dư = 0,24:3/2= 0,16 mol
--> n Al pứ vs fe2o3 = 0,4 - 0,16= 0,24 mol
---> n Fe2O3 = 0,24÷2=0,12mol
--> H = 0,12:0,15.100= 80%
Fe2O3+2Al→Al2O3+2Fe
Al+NaOH+H2O→NaAlO2+\(\frac{3}{2}\)H2↑
⇒nH2=0,24 mol, nAl (ban đầu)=\(\frac{10,8}{27}\)= 0,4 mol , ⇒nAl (tham gia p/u)=0,24 (mol) ⇒nFe2O3=0,12 mol
⇒H=\(\frac{0,12}{0,15}\cdot100\%\)=80%

a) 2Al + Fe2O3 -to-> 2Fe + Al2O3 (1)
nAl=0,2(mol)
nFe2O3=0,05(mol)
lập tỉ lệ
\(\dfrac{0,2}{2}>\dfrac{0,05}{1}\)
=> Al dư , Fe2O3 hết => bài toán tính theo Fe2O3
theo (1) :
nFe = 2 nFe2O3=0,1(mol)
nAl2O3 =nFe2O3=0,05(mol)
n Al PƯ=2nFe2O3=0,1(mol)
=> nAldư =0,1(mol)
=> M =0,1.27 + 0,05.102 +0,1.56=13,4(g)
b) 2Al + 2H2O + 2NaOH --> 2NaAlO2 + 3H2 (2)
Al2O3 +2NaOH --> 2NaAlO2 + H2O (3)
theo (2) : nH2=3/2 nAldư=0,15(mol)
=> VH2 (tối đa)=0,15.22,4 =3,36(l)
3