Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

đặt công thức là FexOy. ta có : mFe/mO=7/3
=>\(\frac{56x}{16y}=\frac{7}{3}\Rightarrow\frac{x}{y}=\frac{2}{3}\)
=>CTHH: Fe2O3
theo đè bài: cứ 7 gam Fe kết hợp với 3 gam Oxi
\(\Rightarrow\)số mol nguyên tử Fe là= 7/56=0,125(mol) kết hợp với số mol n.tử Oxi là= 3/16=0,1875(mol)
\(\Rightarrow\)\(\frac{nFe}{nO}=\frac{0,125}{0,1875}=\frac{2}{3}\)
Vậy CTHH của hợp chất là Fe2O3

đặt công thức : FexOy
ta có : \(\frac{m_{Fe}}{m_O}=\frac{7}{7}\)=> \(\frac{56x}{16y}=\frac{1}{1}\)<=> \(\frac{x}{y}=\frac{2}{7}\)
=> công thức hh của sắt và Oxi là : Fe2O7

Hợp chất Fe2O3. Gọi hóa trị của Fe là x
Theo quy tắc hóa trị ta có: x. 2 = 3.II ⇒ x = III

Ta có gọi CTHC là FexOy
=> \(\dfrac{56x}{16y}=\dfrac{7}{3}\)
=> \(\dfrac{x}{y}=\dfrac{7\times16}{3\times56}\)
=> \(\dfrac{x}{y}=\dfrac{2}{3}\)
=> CTHC là Fe2O3

Công thức chung của hợp chất F e x O y .
Theo đề bài ta có:
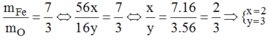
Vậy CTHH của hợp chất là F e 2 O 3 .
Phân tử khối là: 56.2 + 16.3 = 160 (đvC)

3Fe + 2O2 --> Fe3O4 4Al + 3O2 --> 2Al2O3
x ---------------> x/3 y------------------> y/2
Theo đề bài \(\dfrac{\dfrac{x.232}{3}+\dfrac{y.102}{2}}{56x+27y}\) = \(\dfrac{283}{195}\)
Giải pt => x = 3y
=> %mFe = \(\dfrac{mFe}{mFe+mAl}.100\%\)= \(\dfrac{3y.56}{3y.56+27y}.100\%\) = 86,15%
<=> %mAl = 100 - 86,15 = 13,85%
Đặt CTTQ: FexOy
Có: \(\dfrac{m_{Fe}}{m_o}=\dfrac{56x}{16y}=\dfrac{7}{3}\rightarrow\dfrac{x}{y}=\dfrac{7.16}{3.56}=\dfrac{2}{3}\)
\(\rightarrow\left\{{}\begin{matrix}x=2\\y=3\end{matrix}\right.\)
Vậy CTHH của hợp chất là Fe2O3