Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Hai chất khí nhẹ hơn không khí là: H2 (M = 2 g/ mol) và He (M = 4 g/ mol).
- Hai chất khí nặng hơn không khí là: CO2 (M = 44 g/ mol) và SO2 (M = 64 g/ mol).

\(Na_2CO_3+Ba\left(OH\right)_2\rightarrow BaCO_3+2NaOH\)
Tỉ lệ: Số phân tử Na2CO3 : Số phân tử Ba(OH)2 : Số phân tử BaCO3 : Số phân tử NaOH = 1:1:1:2
Áp dụng các bước lập phương trình hoá học, cân bằng phương trình.
PTHH: Na2CO3 + Ba(OH)2 → BaCO3 + 2NaOH
Tỉ lệ số phân tử chất trong phản ứng là:
Số phân tử Na2CO3 : số phân tử Ba(OH)2 : số phân tử BaCO3 : số phân tử NaOH = 1 : 1 : 1 : 2

-Khối lượng phân tử CaCO3 = 40 + 12 + 16 x 3 = 100
-Khối lượng của 0,2 mol CaCO3 = 0,2 x 100 = 20 gam
a)Khối lượng phân từ của calcium carbonate là:
40.1+12.1+16.3=100(amu)
b,m caoco3=ncaco3.mcaco3=0,2.100=20(kg)
Vậy khối lượng của 0,2 mol calcium carbonate là 20(kg)
GOOD LUCK<3

Trả lời:
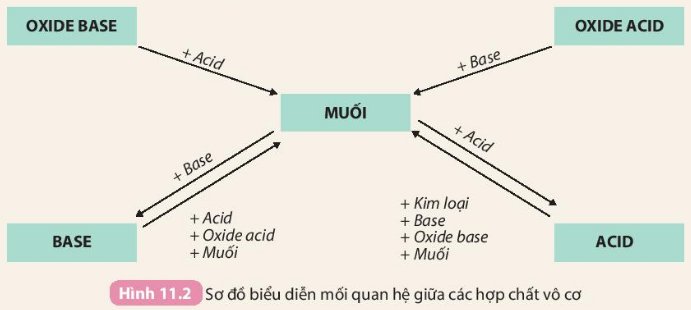
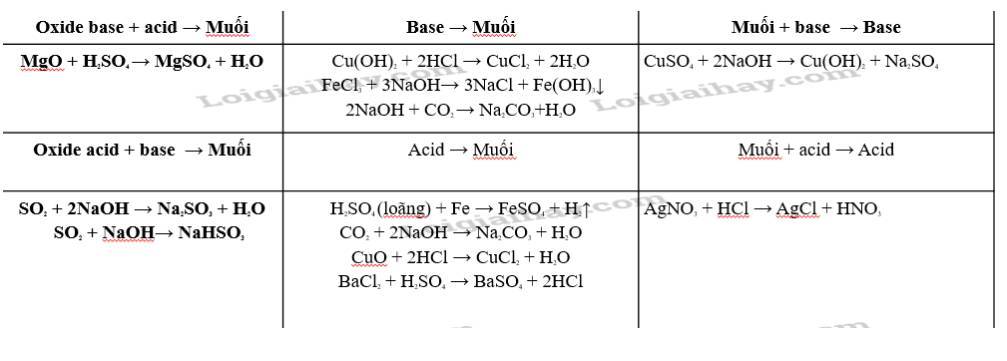
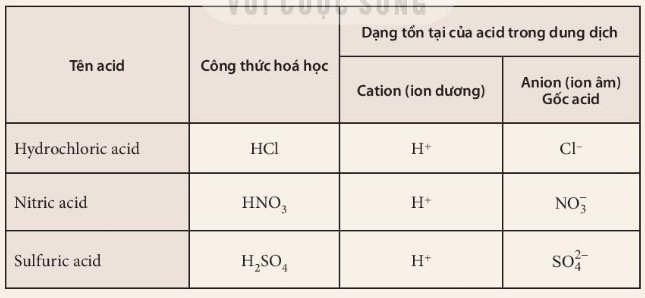
1. Công thức hoá học của các acid đều có chứa nguyên tử H.
2. Dạng tồn tại của acid trong dung dịch đều chứa cation (ion dương) H+.
3. Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+.
1. Đều có nguyên tử H
2. Dạng tồn tại đều chưa ion H+
3. Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+

a. Số nguyên tử Al, số phân tử O2 , số phân tử AL2O3
b. 4Al + 3O2 → 2Al2O3
Tỉ lệ: 4 : 3 : 2

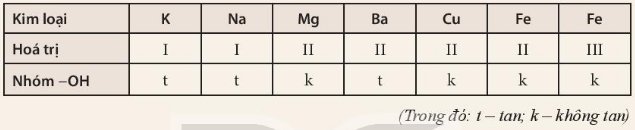
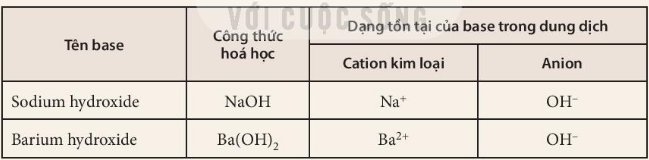
Base không tan:
Mg(OH)2: magnesium hydroxide.
Cu(OH)2: copper(II) hydroxide.
Fe(OH)3: iron(III) hydroxide.
Fe(OH)2: iron(II) hydroxide.
Base kiềm
KOH: potassium hydroxide.
Ba(OH)2:barium hydroxide
NaoOH:sodium hydroxide

1. Có một hay nhiều nhóm OH-
2. Các dung dịch base gồm 1 cation kim loại và anion OH-
3. Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH-
4. Quy tắc gọi tên các base: Tên kim loại (kèm hoá trị đối với kim loại có nhiều hoá trị) + hydroxide.
Tên base Ca(OH)2: Calcium hydroxide.

Tham khảo!
- Phản ứng hoá học giữa chất dinh dưỡng với oxygen cung cấp năng lượng cho cơ thể hoạt động là phản ứng toả nhiệt.
- Ví dụ một số phản ứng toả nhiệt:
+ Phản ứng đốt cháy than;
+ Phản ứng đốt cháy khí gas…
Thức ăn được tiêu hoá chuyển thành các chất dinh dưỡng. Phản ứng hoá học giữa chất dinh dưỡng với oxygen cung cấp năng lượng cho cơ thể hoạt động là phản ứng toả nhiệt
Ví dụ phản ứng toả nhiệt: Phản ứng tôi vôi
Để tìm công thức hóa học của hợp chất dựa trên phần trăm khối lượng của các nguyên tố và khối lượng phân tử, chúng ta sẽ thực hiện các bước sau:
Bước 1: Xác định phần trăm khối lượng của nguyên tố O
Bước 2: Tính số mol của từng nguyên tố
Giả sử ta có 100 g hợp chất, ta có:
Tính số mol:
\(\text{S} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{mol}\&\text{nbsp};\text{Ca} = \frac{40 \textrm{ } \text{g}}{40 \textrm{ } \text{g}/\text{mol}} = 1 \textrm{ } \text{mol}\)
\(\text{S} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{mol}\&\text{nbsp};\text{C} = \frac{12 \textrm{ } \text{g}}{12 \textrm{ } \text{g}/\text{mol}} = 1 \textrm{ } \text{mol}\)
\(\text{S} \overset{ˊ}{\hat{\text{o}}} \&\text{nbsp};\text{mol}\&\text{nbsp};\text{O} = \frac{48 \textrm{ } \text{g}}{16 \textrm{ } \text{g}/\text{mol}} = 3 \textrm{ } \text{mol}\)
Bước 3: Tính tỉ lệ số mol
Tỉ lệ số mol của các nguyên tố là:
Bước 4: Viết công thức hóa học
Dựa vào tỉ lệ trên, công thức hóa học của hợp chất là:
\(\text{CaC}_{1} \text{O}_{3} \text{hay} \text{CaCO}_{3}\)
Bước 5: Kiểm tra khối lượng phân tử
Khối lượng phân tử của \(\text{CaCO}_{3}\) là:
\(40 + 12 + \left(\right. 3 \times 16 \left.\right) = 40 + 12 + 48 = 100 \textrm{ } \text{g}/\text{mol}\)
Khối lượng phân tử tính toán khớp với khối lượng phân tử đã cho (100 amu).
Kết luận
Công thức hóa học của hợp chất là CaCO₃ (canxi cacbonat).
tham khảo
Tick cho mình 2 câu trả lời mình xin