Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

gọi hóa trị của M là n
p2:
Fe--> Fe+2 + 2e
x------------------>2x
M--> M+n + ne
y----------------->yn
2x+ yn= 1,2*2
P3
Fe--> Fe+3 + 3e
M--> M+n + ne
3x+ yn= 1,5*2
--> x=0,6, y=0,4
--> n=3--> ox M là M2O3
mM2O3=66,8- 232*0,2= 20,4
--> M(M2O3)=102--> M=27: Al
mFe=100,8
mAl=32,4

Câu 1:
1/ Viết phương trình hóa học:
S + O2→ SO2
2SO2 + O2→ 2SO3
SO3 + H2O → H2SO4
H2SO4 + Zn→ ZnSO4 + H2
H2 + CuO→ Cu + H2O
2/ Gọi tên các chất:
| Li20 | Liti oxit | P2O5 | Đi photpho penta oxit |
| Fe(NO3)3 | Sắt (III) nitrat | HBr | Axit brom hyđric |
| Pb(OH)2 | Chì (II) hyđroxit | H2SO4 | Axit sunfuric |
|
Na2S |
Natri sunfua | Fe2(SO4)3 | Sắt (III) sunfat |
| Al(OH)3 |
Nhôm hyđroxit |
CaO | Canxi oxit |
Câu 4:
PTHH: CuO + H2→ Cu + H2O (1)
PbO + H2→ Pb + H2O (2)
Sau phản ứng chất khí dẫn qua bình đựng P2O2 thấy khối lượng bình giảm 0,9 gam =>mH20 = 0,9 gam => nH20 = 0,9 /18 = 0,05 mol
Gọi số mol CuO và PbO lần lượt là x mol và y mol (x,y > 0)
Ta có PTĐS: 80x + 223y = 5,43 =>
Theo PTHH (1) ta có: nH20 = nCuO= x mol
Theo PTHH (2) ta có: nH2O = nPbO = y mol
x + y = 0,05 => y = 0,05 – x (b)
Thay (b) vào (a) giai ra ta có x = 0,04; y = 0,01 mol
Vậy % theo khối lượng của CuO và PbO là 59%; 40,06%

- Chất rắn không tan là Cu
\(\Rightarrow\) %Cu = \(\dfrac{3.100}{21,6}\)\(\approx\) 13,9%
\(\Rightarrow\) mhh Zn và Fe = 21,6 - 3 = 18,6
nH2 = 0,3 mol
Đặt nZn = x (mol); nFe = y (mol); ( x, y > 0 )
Zn + H2SO4 \(\rightarrow\) ZnSO4 + H2 (1)
Fe + H2SO4 \(\rightarrow\) FeSO4 + H2 (2)
Từ (1)(2) ta có hệ pt
\(\left\{{}\begin{matrix}65x+56y=18,6\\x+y=0,3\end{matrix}\right.\)
\(\Rightarrow\) \(\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\Rightarrow\) %Zn = \(\dfrac{0,2.65.100}{21,6}\) \(\approx\) 60,2%
\(\Rightarrow\) %Fe = \(\dfrac{0,1.56.100}{21,6}\) \(\approx\) 25,9%
\(\Rightarrow\) mhh muối = ( 0,2.161 ) + ( 0,1.152 ) = 47,4 (g)
\(\Rightarrow\) %ZnSO4 = \(\dfrac{0,2.161.100}{47,4}\) \(\approx\) 67,9%
\(\Rightarrow\) %FeSO4 = \(\dfrac{0,1.152.100}{47,4}\) \(\approx\) 32,1%

a.
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
nAl (dư, trong ½ phần) = 2/3.nH2 = 2/3.8,96/22,4 = 4/15 mol
nH2 = 26,88/22,4 = 1,2 mol
2Al + 6HCl = 3H2 + 2AlCl3
4/15..............0,4 mol
Fe + 2HCl = H2 + FeCl2
0,8..............0,8 mol
Phần không tan chỉ gồm Fe
Ta có : mFe = 44,8%m1 => m1 = m2 = 0,8.56.100/44,8 = 100g
b.
nFe (trong cả 2 phần) = 0,8.2 = 1,6 mol
2Al + Fe2O3 = Al2O3 + 2Fe
1,6....0,8.........0,8.........1,6 mol
=> mFe2O3 (ban đầu) = 0,8.160 = 128g
nAl (ban đầu) = nAl (ph.ư) + nAl (dư, trong 2 phần) = 1,6 + 2.4/15 = 32/15 mol
=> mAl (ban đầu) = 27.32/15 = 57,6g
sai rồi bạn ơi . 2 phần này có bằng nhau đâu mà làm theo kiểu v @@

P1: \(n_{H_2}=0,08\left(mol\right)\)
\(2A+2nHCl-->2ACl_n+nH_2\)
x....................................................xn/2
\(2B+2mHCl-->2BCl_m+mH_2\)
y........................................................ym/2
\(\dfrac{xn}{2}+\dfrac{ym}{2}=0,08\Rightarrow ym+xn=0,16\left(1\right)\)
Phần 2
Vì sau phản ứng còn lại 1 chất rắn không tan nên nếu A tan thì B k tan
\(n_{H_2}=0,06\left(mol\right)\)
\(A+\left(4-n\right)NaOH+\left(n-2\right)H_2O-->Na_{4-n}AO_2+\dfrac{n}{2}H_2\)
x.................................................................................................xn/2
\(\dfrac{xn}{2}=0,06=>xn=0,12\left(2\right)\)
Thay (2) vào (1)
\(ym=0,16-0,12=0,04\left(3\right)\)
\(\dfrac{Ax}{By}=\dfrac{9}{4}\left(4\right)\)
Phần 3
\(4A+nO_2-t^0->2A_2O_n\)
x................................x/2
\(4B+mO_2-t^0->2B_2O_m\)
y.................................y/2
\(\dfrac{\left(2A+16n\right)x}{2}+\dfrac{\left(2B+16m\right)y}{2}=2,84\)
\(Ax+8nx+By+8ym=2,84\left(5\right)\)
Thay (1)vào 5
\(Ax+By+8.0,16=2,84\)
\(Ax+By=1,56\left(6\right)\)
Từ (4)(6)
\(\Rightarrow Ax=1,08\) \(By=0,48\)
\(A=\dfrac{1,08}{x}=\dfrac{1,08}{\dfrac{0,12}{n}}=9n\)
Nếu n=1 => A=9(loại)
Nếu n=2=>A=18(loại)
Nếu n=3=>A=27(chọn)
\(B=\dfrac{4,08}{y}=\dfrac{0,48}{\dfrac{0,04}{m}}=12m\)
Nếu m=1=>B=12(loại)
Nếu m=2=>B=24(chọn)
Nếu m=3=>B=36(loại)
Vậy A B lần lượt là Al và Mg
Khối lượng mỗi phần là 1,56(g) ( tính ở trên )

Bài 4. Axit axetic có công thức C2H402. Hãy tính thành phần phần trăm khối lượng của các nguyên tố trong axit axetic.
Lời giải:
Từ C2H4O2 ta có: M = 60 g/mol; mC = 2 x 12 = 24 g; mH = 4 x 1 = 4 g;
MO = 2 x 16 = 32 g.
%C = (24 : 60) x 100% = 40%; %H = (4 : 60) x 100% = 6,67%;
%O = 100% - 40% - 6,67% = 53,33%.

bài 1
Goi x la so gam cua CuO
x+15,2 la so gam cua Fe3O4
Ta co x+(x+15,2)=31,2 =>x=8
mCuO=8g=>n=0,1mol
mFe3O4=23,2g=>n=0,1 mol
CuO + H2-->Cu+ H2O
0,1 0,1
Fe3O4+4H2O--->Fe+H2O
0,1 0,1
mCu=0,1.64=6,4g
mFe=0,1.56=5,6g
bài 2
nkhí = 2,24 / 22,4 = 0,1 mol
a) Phương trình hóa học của phản ứng:
Zn + H2SO4 loãng → ZnSO4 + H2
nZn = 0,1 mol.
b) Khối lượng chất rắn còn lại: mZn = 6,5g
Khối lượng chất rắn còn lại: mCu = 10,5 – 6,5 = 4g.

CuO + 2HCl → CuCl2 + H2O (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
\(n_{HCl}=0,2\times3,5=0,7\left(mol\right)\)
a) Gọi x,y lần lượt là số mol của CuO và Fe2O3
Ta có: \(\left\{{}\begin{matrix}80x+160y=20\\2x+6y=0,7\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
Vậy \(n_{CuO}=0,05\left(mol\right)\Rightarrow m_{CuO}=0,05\times80=4\left(g\right)\)
\(n_{Fe_2O_3}=0,1\left(mol\right)\Rightarrow m_{Fe_2O_3}=0,1\times160=16\left(g\right)\)
\(\%m_{CuO}=\frac{4}{20}\times100\%=20\%\)
\(\%m_{Fe_2O_3}=100\%-20\%=80\%\)
b) Theo pT1: \(n_{CuCl_2}=n_{CuO}=0,05\left(mol\right)\)
\(\Rightarrow m_{CuCl_2}=0,05\times135=6,75\left(g\right)\)
Theo pT2: \(n_{FeCl_3}=2n_{Fe_2O_3}=2\times0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{FeCl_3}=0,2\times162,5=32,5\left(g\right)\)
\(m_{muối}=32,5+6,75=39,25\left(g\right)\)
gọi a, b lần lượt là số mol của CuO và Fe2O3 có trong hỗn hợp
PTPU
CuO+ 2HCl\(\rightarrow\) CuCl2+ H2O
..a.........2a............a................ ( mol)
Fe2O3+ 6HCl\(\rightarrow\) 2FeCl3+ 3H2O
..b............6b...........2b................. ( mol)
có: nHCl= 0,2. 3,5= 0,7( mol)
ta có hệ pt:
\(\left\{{}\begin{matrix}80a+160b=20\\2a+6b=0,7\end{matrix}\right.\)
\(\Rightarrow\) \(\left\{{}\begin{matrix}a=0,05\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\) %mCuO= \(\frac{0,05.80}{20}\). 100%= 20%
%mFe2O3= 100%- 20%= 80%
theo các PTPU có:
nCuCl2= nCuO= 0,05( mol)
nFeCl3= 2nFe2O3= 0,2( mol)
\(\Rightarrow\) mCuCl2= 0,05. 135= 6,75( g)
mFeCl3= 0,2. 162,5= 32,5( g)

Mình thấy nó dư dư cái tỉ khối giữa khí Z với H2 quá :)
Lần lượt gọi số mol của FeO và Fe2O3 là x,y ta có:
Số mol của CO2: \(n_{CO_2}=\frac{V}{22,4}=\frac{22,4}{22,4}=1\left(mol\right)\)
\(PTHH_{\left(0\right)}:Fe+CO\rightarrow kpu\)
\(PTHH_{\left(1\right)}:FeO+CO\rightarrow Fe+CO_2\)
( mol) 1 1 1 1
(mol) x x x
\(PTHH_{\left(2\right)}:Fe_2O_3+3CO\rightarrow2Fe+3CO_2\)
(mol) 1 3 2 3
(mol) y \(\frac{y}{2}\) \(\frac{y}{3}\)
Ta có: \(m_{Fe}=14\%.m_{Fe_2O_3}=14\%.\left[y.\left(56.2+16.3\right)\right]=14\%.160y=22,4y\)
Theo 2pt trên ta có:
\(n_{CO_2\left(1\right)}+n_{CO_2\left(2\right)}=x+\frac{y}{3}=1\)
\(m_{Fe}+m_{FeO}+m_{Fe_2O_3}=22,4y+\left(56+16\right)x+160y=182,4y+72x=6\)
Ta có hpt:
\(\left\{{}\begin{matrix}x+\frac{y}{3}=1\\72x+182,4x=6\end{matrix}\right.\)
Giải hpt ta có: \(x=\frac{41}{36};y=-\frac{5}{12}\)
\(\Rightarrow m_{Fe\left(Y\right)}=m_{Fe\left(1\right)}+m_{Fe\left(2\right)}=56\left(\frac{41}{36}-\frac{5}{12}\right)=40,4\left(g\right)\)
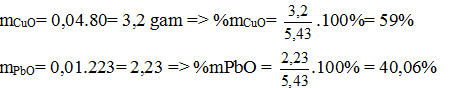
a) 40% S còn lại là oxi
Ta có
m\(_S:m_O=40:60\)
=>n\(_S:n_O=\frac{40}{32}:\frac{60}{16}\)
=1,25:3,75
=1:3
CTHH:SO3
b) mCu:mO=4:1
=>n\(_{Cu}:n_O=\frac{4}{64}:\frac{1}{16}\)
=0,0625:0,0625
=1:1
CTHH:CuO
c) Cứ 7g Fe kết hợp với 3g O
m\(_{Fe}:m_O=7:3\)
=>n\(_{Fe}:n_O=\frac{7}{56}:\frac{3}{16}\)
=0,125:0,1875
=12:3
CTHH"Fe2O3
d) Có 1 phần khối lượng là H và 8 phần khối lượng là O
m\(_H:m_O=1:8\)
=>n\(_H:n_O=\frac{1}{1}:\frac{8}{16}=1:0,5\)
CTHH:H2O
Chúc bạn học tốt
a, \(n_S:n_O=\frac{40}{32}:\frac{60}{16}=1:3\)
CTHH : SO3
b,
\(n_{Cu}:n_O=\frac{4}{64}:\frac{1}{16}=1:1\)
=> CTHH : CuO
c,\(n_{Fe}:n_O=\frac{7}{56}:\frac{3}{16}=2:3\)
=>CTHH: Fe2O3
d,\(n_H:n_O=\frac{1}{1}:\frac{8}{16}=1:0,5\)
=>CTHH : H2O