Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong máy có một chất oxi hóa là Crom(VI) oxit CrO3 để làm chất phản ứng nhằm phát hiện ra rượu Etylic. Máy đo nồng độ cồn thật ra là ống có chứa chất crom(VI) oxit CrO3
Bên trong thân máy có chứa Crom(VI) oxit CrO3 - một chất hóa học có thể giúp máy phân tích, xác định nồng độ cồn.
Tại vì :
Các loại đồ uống có cồn như rượu, bia chứa thành phần chính là rượu Etylic - một chất rất dễ bị oxy hóa. Chất Crom(VI) oxit CrO3 có trong máy đo nồng độ cồn khi gặp rượu Etylic sẽ xảy ra phản ứng hóa học và tạo ra một chất mới là Cr2O3 có màu đen.
Như vậy, khi người tham gia giao thông có sử dụng rượu bia thổi vào máy đo nồng độ cồn của công an, CSGT, chất Crom(VI) oxit CrO3 sẽ bị rượu Etylic khử thành hợp chất màu đen Cr2O3. Tiếp đó, máy kiểm tra nồng độ cồn sẽ dựa vào sự biến đổi màu sắc để xác định nồng độ cồn và hiển thị kết quả lên màn hình.

Đáp án C
Gọi công thức muối là CaX2
CaX2 + 2AgNO3 → Ca(NO3)2 +2AgX
40+2X 2.(108+X)
0,2 0,376
Ta có → X=80 (Br)
Công thức. CaBr2

Tăng giảm khối lượng ta có; $n_{NaX}=\frac{2,35-1,5}{108-23}=0,01(mol)$
$\Rightarrow M_{NaX}=150\Rightarrow X=127$
Vậy CTHH của muối là NaI
Bảo toàn nguyên tố X và Ag ta có: $n_{AgNO_3}=n_{AgI}=0,01(mol)\Rightarrow C_{M}=1M$
PTHH: \(NaX+AgNO_3\rightarrow NaNO_3+AgX\downarrow\)
Theo PTHH: \(n_{NaX}=n_{AgX}\)
\(\Rightarrow\dfrac{1,5}{23+X}=\dfrac{2,35}{108+X}\) \(\Leftrightarrow X=127\) (Iot)
\(\Rightarrow\) Công thức: NaI
Ta có: \(n_{AgNO_3}=n_{NaI}=\dfrac{1,5}{150}=0,01\left(mol\right)\)
\(\Rightarrow C_{M_{AgNO_3}}=\dfrac{0,01}{0,01}=1\left(M\right)\)

Zn + 2HCl => ZnCl2 + H2
Na2CO3 + 2HCl=> 2NaCl + H2O + CO2
MY = 0,5875.32 = 18,8
áp dụng sơ đồ đường chéo ta đc nH2 : nCO2 = 3:2
mà nH2 = nZn ; nCO2 = nNa2CO3
=> nZn = 3/2 nCO2
ta có \(65.\frac{3}{2}x+106x=4,07\left(g\right)\) => x= 0,02 mol => nZn =0,03
a. => % na2CO3 = \(\frac{0,02.106}{4,07}.100\%=52,088\%\)
=> % Zn = 47,912%
b. nHCl pư = 2 .nZn + 2. nNa2CO3 = 2.0,03+ 2.0,02 = 0,1
=> mHCl pư = 0,1.36,5 = 3,65 (g)
=> m HCl dùng = 3,65.120% = 4,38 (g)
=> mdd HCl = \(\frac{4,38.100}{25}=17,52\)
=> mdd = 4,07 + 17,52 - 0,03.2-0,02.44 = 20,65(g)
mHCl dư = 4,38 - 3,65 = 0,73(g)
C% HCl dư = \(\frac{0,73}{20,65}.100\%\) = 3,535%

Đáp án C
Gọi công thức muối cần tìm là MX2.
Khi cho 150 gam dung dịch X tác dụng với dung dịch Na2CO3 dư có phản ứng:
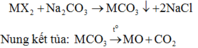
Do đó khí hấp thụ vào dung dịch KOH là CO2.
Vì sau phản ứng trong dung dịch vẫn còn KOH nên sản phẩm tạo thành là K2CO3:
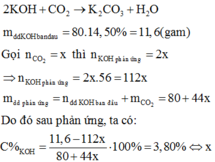 = 0,75
= 0,75

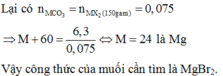

ta có \(CaX_2+2AgNO_3\rightarrow2AgX+Ca\left(NO_3\right)_2\)

a.
Do E gồm hai oxit nên Mg, CuCl2 hết, Fe đã phản ứng
Phương trình
Mg + CuCl2 \(\rightarrow\) MgCl2 + Cu (1)
Fe + CuCl2 \(\rightarrow\) FeCl2 + Cu (2)
Khi cho NaOH dư vào
2NaOH + MgCl2 \(\rightarrow\) Mg(OH)2 + 2NaCl (3)
2NaOH + FeCl2 \(\rightarrow\) Fe(OH)2 + 2NaCl (4)
Khi nung
Mg(OH)2 \(\underrightarrow{t^o}\) MgO + H2O (5)
4Fe(OH)2 +O2 \(\underrightarrow{t^o}\) 4Fe2O3 + 4H2O (6)
b.
Đặt số mol của Fe, Mg có ban đầu lần lượt là x, y, số mol Fe dư là t (x, y>0, t\(\ge\)0)
Có hệ \(\begin{cases}24x+56y+0t=3,16\\40x+64y-8t=3,84\\40x+80y-80t=1,4\end{cases}\)\(\Rightarrow\)\(\begin{cases}x=0,015mol\\y=0,05mol\\t=0,04mol\end{cases}\)
Vậy trong hỗn hợp đầu %mMg = \(\frac{0,015.24}{3,16}.100\)=11,392%
%mFe=100%-11,392% = 88,608%
Nồng độ của CuCl2: z =0,025:0,25=0,1M


1- Halogen có hóa trị 1 . gọi công thức muối là \(CaM_2\)
PTHH : \(CaM_2+2AgNO_3\rightarrow2AgM+CaNO_3\)
theo Pt: (40+2M) 2(108+M)
theo đề bài: 0,2g 0,376g
Ta có: \(\frac{40+2M}{0,2}=\frac{2\left(108+M\right)}{0,376}\) \(\Leftrightarrow0,376\times\left(40+2M\right)=0,2\times2\left(108+M\right)\)
\(\Rightarrow M=80\\\)
Vậy M là Br \(\Rightarrow\) Công thức hợp chất A là \(CaBr_2\)