
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O(1)$
$Fe_2(SO_4)_3 + Fe\ to 3FeSO_4(2)$
Gọi $n_{Fe_2(SO_4)_3} = a(mol) ; n_{FeSO_4} = b(mol)$
Ta có : $400a + 152b = 62,8(1)$
$n_{SO_2} = 0,15(mol)$
$n_{Fe_2(SO_4)_3(1)} = \dfrac{1}{3}n_{SO_2} = 0,05(mol)$
$n_{Fe_2(SO_4)_3(2)} = \dfrac{1}{3}n_{FeSO_4} = \dfrac{b}{3}$
Suy ra:
$0,05 - \dfrac{b}{3} = a(2)$
Từ (1)(2) suy ra $a = \dfrac{45}{112} ; b = -1,055<0$
=> Sai đề

X: Fe3O4
Y: FeCl2
Z: FeCl3
T: Fe(OH)2
U: Fe(OH)3
A: NaCl (hoặc H2O)
B: H2O (hoặc NaCl)
D: H2 (hoặc Cl2)
E: Cl2 (hoặc H2)
F: NaOH
G: HCl
PTHH:
a) NaCl + H2O -dpmn----> 1/2 H2 + 1/2 Cl2 + NaOH
H2 + Cl2 -to-> 2 HCl
HCl + NaOH -> NaCl + H2O
b) 3 Fe +2 O2 -to->Fe3O4
Fe3O4 + 8 HCl -> FeCl2 +2 FeCl3 + H2O
FeCl2 + 2 NaOH -> Fe(OH)2 + 2 NaCl
FeCl3 +3 NaOH -> Fe(OH)3 + 3NaCl
Chúc em học tốt!

https://hoc24.vn/hoi-dap/question/71825.html bạn vào đây tham khảo nè

Đặt CTHH của oxit sắt cần tìm : FexOy
PTHH : FexOy + yH2 = xFe + yH2O
0.2
Theo giả thiết C%H2SO4 còn 98% -3.405%= 94.595%
Hoặc \(\dfrac{98}{100+m_{H2O}}\) =0.94595
giải được mH2O=3.6g
nH2O=0.2 mol
Chất rắn thu được là Fe , nH2 thoát ra=3.36/22.4=0.15 mol
PTHH : Fe + H2SO4 --> FeSO4 + H2
0.15 0.15
Ta có tỉ lệ : nFe:nH2O = x:y = 0,15:0,2 = 3:4
Vậy CTHH của oxit sắt là Fe3O4

Kim cương là một dạng thù hình của nguyên tố Cacbon. (Thành phần chính của kim cương là Cacbon). Trong điều kiện áp suất cao và nhiệt độ cao thì các nguyên tử Cacbon kết hợp lại với nhau tạo thành kim cương.


CuO + H2SO4 \(\rightarrow\)CuSO4 + H2O (1)
Cr2O3 + 3H2SO4 \(\rightarrow\)Cr2(SO4)3 + 3H2O (2)
Đặt nCuO=a
nCr2O3=b
Ta có :
\(\left\{{}\begin{matrix}80a+152b=69,2\\160a+392b=169,2\end{matrix}\right.\)
=>a=0,2;b=0,35
mCuO=80.0,2=16(g)
mCr2O3=69,2-16=53,2(g)
b;Theo PTHH 1 và 2 ta có:
nCuO=nH2SO4=0,2(mol)
3nCr2O3=nH2SO4=1,05(mol)
nCuO=nCuSO4=0,2(mol)
nCr2O3=nCr2(SO4)3=0,35(mol)
mH2SO4=(1,05+0,2).98=122,5(g)
mdd H2SO4=122,5:\(\dfrac{1,96}{100}=6250\left(g\right)\)
mCuSO4=0,2.160=32(g)
mCr2(SO4)3=392.0,35=137,2(g)
C% dd CuSO4=\(\dfrac{32}{6250+69,2}.100\%=0,5\%\)
C% dd Cr2(SO4)3=\(\dfrac{137,2}{6250+69,2}.100\%=2,17\%\)

Gọi CTTQ oxit đó là:Cu2On(n là hóa trị của Cu)
%mCu=\(\dfrac{2.64}{2.64+16n}\).100%=88,89%
=>\(\dfrac{128}{128+16n}\).100%=88,89%
=>12800=11377,92+1422,24n
=>1422,24n=1422,08
=>n=1
Vậy CTHH oxit là:Cu2O

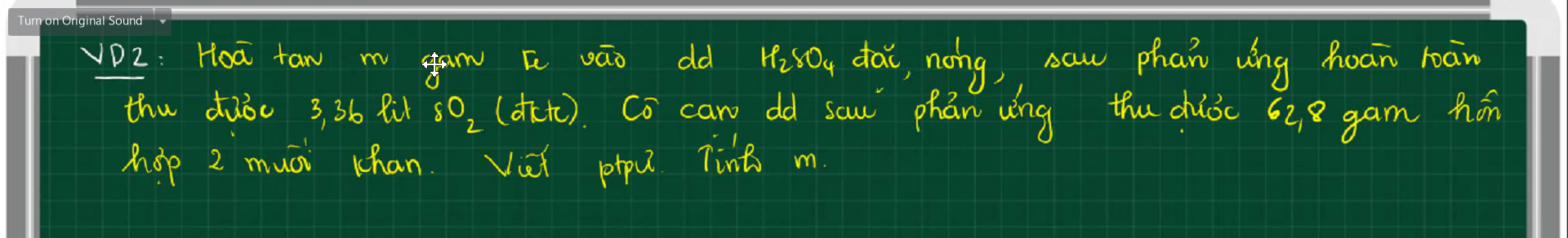


 Giúp mình nha !!!
Giúp mình nha !!!
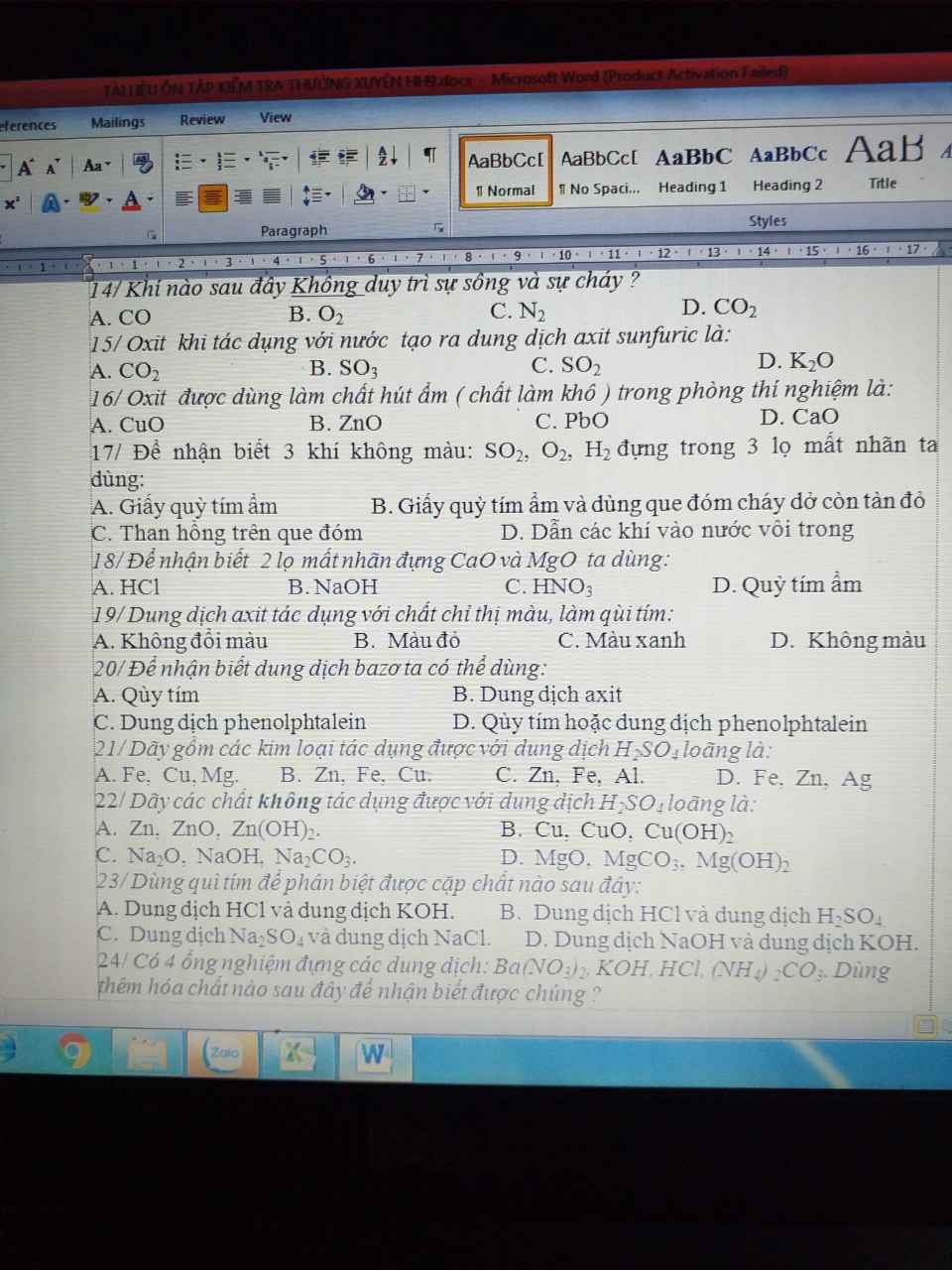
14c
15b
16d
17b
18d
19b
20d
21c
22b
23a