Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích: Đáp án A
n BaCO3 = n CO2 = 9,062 : 197 = 0,046 mol
=> n O đã pư = 0,046 mol => m O = 0,736 g
Bảo toàn khối lượng m hhđầu = m O pư + m hh sau = 0,736 + 4,784 = 5,52 g
Ta có hệ 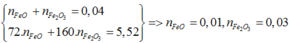
=> m FeO = 0,72 g
=> % m FeO = 13,04%
Chú ý : Bản chất của phản ứng dùng CO hay H2 khử oxit kim loại là việc CO hay H2 lấy O trong oxit ra tạo thành CO2 và H2O , số mol CO , H2 sẽ bằng số mol O ( nằm trong oxit ) đã bị lấy ra

Đáp án D
nCO2 = nBACO3 = 9,062/197 = 0,046
BTKL => mX = mY + mCO2 – mCO = 4,784 + 0,046(44 – 28) = 5,52
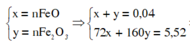
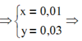
%mFeO = 0,01.72.100%/5,52 = 13,04%

Đáp án C
X + CO tạo thành chất rắn Y gồm các kim loại Mg, Fe, Cu và hỗn hợp khí z gồm CO2 và CO dư
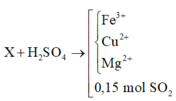
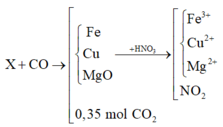
Áp dụng định luật bảo toàn mol electron
Trong thí nghiệm 1: ne nhường = ne nhận = 0,3(mol)
ne nhường trong thí nghiệm = ne nhường (1) + 2.nCO2 =1(mol) = ne nhận (2) = nNO2
Chú ý: Với các bài toán của phản ứng oxi hoá khử gồm nhiều quá trình ta thường sử dụng bảo toàn electron cho toàn bộ các quá trình, bỏ qua giai đoạn trung gian.

Đáp án D:
![]()
Bảo toàn electron cho quá trình khử Oxit của COta có(l)
ne cho = ne nhận ne nhận
Bảo toàn e cho quá trình Oxi hóa bởi H2SO4 (2)
=> ne cho = ne nhận ne cho
Vì các Oxit trước quá trình 1 và sau quá trình 2 ở trạng thái có số oxi hóa cao nhất
=> ne nhận = ne cho
Vì các Oxit trước quá trình 1 và sau quá trình 2 ở trạng thái có số oxi hóa cao nhất
=> ne nhận = ne cho
![]()

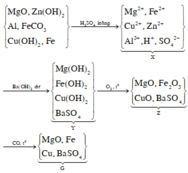
Theo đề bài ta có : nkt = nBaCO3 = 1,97/197 = 0,01 (mol)
PTHH :
\(FeO+CO-^{t0}->Fe+CO2\uparrow\)
\(Fe2O3+3CO-^{t0}->2Fe+3CO2\uparrow\)
\(Fe3O4+4CO-^{t0}->3Fe+4CO2\uparrow\)
CO2 + Ba(OH)2 - > BaCO3\(\downarrow\) + H2O
0,01mol........................0,01mol
Theo các PTHH ta có : nCo = nCo2 = 0,01 mol
Áp dụng đlbtkl ta có :
mX + mCO = mY + mCO2
=> mY = 4,64 + 0,01.28 - 0,01.44 = 4,48(g)
Vậy....