Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(pH=14+log\left[OH^-\right]=10\)
\(\Rightarrow\left[OH^-\right]=10^{-4}\)
\(n_{NaOH}=10^{-4}\cdot0.3=3\cdot10^{-5}\left(mol\right)\)
\(m_{NaOH}=3\cdot10^{-5}\cdot40=1.2\cdot10^{-3}\left(g\right)\)

pH=10
=>pOH=4
=>[OH]=10^-4
=>[NaOH]=10^-4 M
=>nNaOH=3*10^-5
=>mNaOH=0,00069g

a)
\(\begin{array}{l}{{\rm{n}}_{{\rm{HCl}}}}{\rm{ = 0}}{\rm{,5}}{\rm{.0}}{\rm{,2 = 0}}{\rm{,1 (mol)}}\\{{\rm{V}}_{{\rm{dd}}}}{\rm{ = 0}}{\rm{,5 + 0}}{\rm{,5 = 1 (l)}}\\ \Rightarrow {\rm{(HCl) = }}\frac{{{\rm{0}}{\rm{,1}}}}{{\rm{1}}}{\rm{ = 0}}{\rm{,1 (M)}}\\{\rm{HCl}} \to {{\rm{H}}^{\rm{ + }}}{\rm{ + C}}{{\rm{l}}^{\rm{ - }}}\\{\rm{0}}{\rm{,1}} \to {\rm{ 0}}{\rm{,1}}\\ \Rightarrow {\rm{(}}{{\rm{H}}^{\rm{ + }}}{\rm{) = (HCl) = 0}}{\rm{,1 (M)}}\end{array}\)
\( \Rightarrow \) pH = -lg(0,1) = 1
b)
\(\begin{array}{l}{\rm{pH = 12}} \Rightarrow {\rm{(}}{{\rm{H}}^{\rm{ + }}}{\rm{) = 1}}{{\rm{0}}^{{\rm{ - 12}}}}{\rm{(M)}}\\ \Rightarrow {\rm{(O}}{{\rm{H}}^{\rm{ - }}}{\rm{) = }}\frac{{{\rm{1}}{{\rm{0}}^{{\rm{ - 14}}}}}}{{{\rm{1}}{{\rm{0}}^{{\rm{ - 12}}}}}}{\rm{ = 1}}{{\rm{0}}^{{\rm{ - 2}}}}{\rm{(M)}}\\{\rm{NaOH}} \to {\rm{N}}{{\rm{a}}^{\rm{ + }}}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}}\\{10^{ - 2}} \leftarrow {\rm{ }}{10^{ - 2}}\\ \Rightarrow {\rm{(NaOH) = (O}}{{\rm{H}}^{\rm{ - }}}{\rm{) = 1}}{{\rm{0}}^{{\rm{ - 2}}}}{\rm{(M)}}\\ \Rightarrow {{\rm{n}}_{{\rm{NaOH}}}}{\rm{ = 1}}{{\rm{0}}^{{\rm{ - 2}}}}{\rm{.0}}{\rm{,1 = 1}}{{\rm{0}}^{{\rm{ - 3}}}}{\rm{(mol)}}\\ \Rightarrow {{\rm{m}}_{{\rm{NaOH}}}}{\rm{ = 1}}{{\rm{0}}^{{\rm{ - 3}}}}{\rm{.40 = 0}}{\rm{,04(g)}}\end{array}\)

CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag↓ + 2NH4NO3 (1)
CH3COOH + NaOH → CH3COONa + H2O (2)
Theo (1):
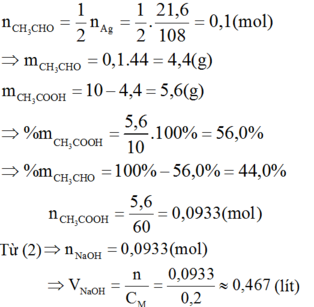

Khi pH = 10 thì [H+] = 1.10-10M và
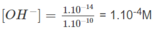
nghĩa là cần có 1. 10 - 4 mol NaOH trong 1 lít dung dịch.
Vậy trong 250 ml (0,25 lít) dung dịch cần có 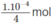 NaOH hoà tan, nghĩa là cần có
NaOH hoà tan, nghĩa là cần có
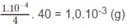 NaOH
NaOH

Giải thích các bước giải:
pH = 9 → [H+] = 10−9(M)
[H+].[OH-]=10−14
→ [OH-] = 10−5(M)
→ nOH- = 10−5 . 1 = 10−5(mol)
pH=8 → [H+] = 10−8(M)
[H+].[OH-]=10−14
→ [OH-] = 10−6(M)
Gọi x lít là thể tích nước cần dùng
Ta có
\(\dfrac{10^{-5}}{x+1}\)= 10-6
→x=9
Chọn câu C.9 lít

Câu 1 :
Gọi thể tích dung dịch ban đầu là V(lít)
$[H^+] = 10^{-3}V(mol)$
Thể tích dung dịch lúc sau là :
$V' = \dfrac{10^{-3}.V}{10^{-4}} = 10V$
Do đó cần pha loãng dung dịch ban đầu 10 lần thì thu được dung dịch trên

CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag↓ + 2NH4NO3 (1)
CH3COOH + NaOH → CH3COONa + H2O (2)

Ta có: \(pH=14+log\left(OH^-\right)\) \(\Rightarrow log\left(OH^-\right)=-4\)
\(\Rightarrow\left[OH^-\right]=C_{M_{NaOH}}=0,0001\left(M\right)\)
\(\Rightarrow n_{NaOH}=0,0001\cdot0,25=2,5\cdot10^{-5}\left(mol\right)\)
\(\Rightarrow m_{NaOH}=2,5\cdot10^{-5}\cdot40=0,001\left(g\right)\)