Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol Fe(OH)3, Mg(OH)2 là a,b (mol)
PTHH: \(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H2O\)
________a ------------> 0,5a____________(mol)
\(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
b-----------------> b_________(mol)
=> \(\left\{{}\begin{matrix}107a+58b=27,2\\160.0,5a+40b=27,2-7,2\end{matrix}\right.\) => \(\left\{{}\begin{matrix}a=0,2\left(mol\right)\\b=0,11\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Fe\left(OH\right)_3}=0,2.107=21,4\\m_{Mg\left(OH\right)_2}=0,1.58=5,8\left(g\right)\\m_{Fe_2O_3}=160.0,5.0,2=16g\\m_{MgO}=40.0,1=4\left(g\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{Fe\left(OH\right)_3}=\frac{21,4}{27,2}.100\%=78,68\%\\\%m_{Mg\left(OH\right)_2}=\frac{5,8}{27,2}.100\%=21,32\%\end{matrix}\right.\)

2Fe(OH)3\(\rightarrow\)Fe2O3+3H2O
\(m_{H_2O}=0,81gam\)
\(n_{H_2O}=\dfrac{0,81}{18}=0,045mol\)
\(n_{Fe\left(OH\right)_3\left(PU\right)}=\dfrac{2}{3}n_{H_2O}=\dfrac{2}{3}.0,045=0,03mol\)
\(n_{Fe_2O_3}=0,045:3=0,015mol\)
\(n_{HCl}=0,06.2=0,12mol\)
Fe2O3+6HCl\(\rightarrow\)2FeCl3+3H2O
Fe(OH)3+3HCl\(\rightarrow\)FeCl3+3H2O
\(n_{Fe\left(OH\right)_3\left(dư\right)}=\dfrac{1}{3}\left(0,12-0,015.6\right)=0,01mol\)
\(n_{Fe\left(OH\right)_3\left(bđ\right)}=0,03+0,01=0,06mol\)
H=\(\dfrac{0,03}{0,06}.100=50\%\)

Bài 2:
Dd D gồm Ba(AlO2)2
\(\text{BaO+H2O}\rightarrow\text{Ba(OH)2}\)
\(\text{Ba(OH)2+Al2O3}\rightarrow\text{Ba(AlO2)2+H2O}\)
\(\text{CO2+Ba(AlO2)2+3H2O}\rightarrow\text{2Al(OH)3+Ba(HCO3)2}\)
Phần B không tan gồm FeO và Al2O3
\(\text{FeO+CO}\rightarrow\text{Fe+CO2}\)
\(\text{2Fe+Al2O3}\rightarrow\text{2Al+Fe2O3}\)
\(\text{Fe2O3+3CO}\rightarrow\text{2Fe+3CO2}\)
\(\rightarrow\) E gồm Fe và Al
\(\text{2Al+2NaOH+2H2O}\rightarrow\text{2NaAlO2+3H2}\)
\(\rightarrow\)G gồm Fe
\(\text{Fe+H2SO4}\rightarrow\text{FeSO4+H2}\)
\(\text{10FeSO4+2KMnO4+8H2SO4}\rightarrow\text{5Fe2(SO4)3+2MnSO4+K2SO4+8H2O}\)

2M(NO3)n ---------> M2On + 2nNO2 + n/2O2 (đối với trường hợp kim loại có hóa trị không đổi)
3.6--------------------------1.6
2M+62n ------------------2M+16n (ở đây MM mình viết tắt là M)
=> 3.6/(2M + 62n) = 1.6/(2M+1.6n)
<=>7.2M+57.6n=3.2M+99.2n
<=>4M = 41.6n
<=> M=(41.6n)/4
Chọn n=1 => M=10.4 loại
n=2=> M=20.8 loại
n=3=> M = 31.2 loại
Vậy kim loại không phải là kim loại có một hóa trị nên ta giải theo kim loại có nhiều hóa trị
Đến đây ta cũng có thể biết kim loại là Fe
xM(NO3)n ----------> MxOy + nxNO2 +(nx-y)/2 O2
Ta có: 3.6 gam M(NO3)n thì khối lượng giảm 3.6-1.6 = 2gam
Nếu xM +62n thì khối lượng giảm là xM+62n-(xM+16y) = 62n-16y
=> 3.6/(xM+62n)=2/(62n-16y)
<=> 223.2n -27.6y=2xM+124n
<=> M = (99.2n-27.6y)/(2x) >
Với n=2 thì chỉ có thể x =2, y=3 thôi => M = 56 là Fe
Do n không thể là 1, 3 vì thông thường kim loại có hóa trị bằng 1 chỉ có 1 một hóa trị khi nhiệt, còn kim loại có hóa trị bằng 3 thì khi nhiệt phân cũng sẽ không thay đổi hóa trị.
( Tham khảo thử nhá![]() )
)
Trả lời :
\(2M\left(NO_3\right)_n-->M_2O_n+2nNO_2+\dfrac{1}{2}nO_2\)
\(\dfrac{3,6}{M+14n+48n}=\dfrac{1,6.2}{2M+n.16}\)
giải ra rồi biện luận

PTHH:
Cu + H2SO4 ---x--->
Fe + H2SO4 ---> FeSO4 + H2 (1)
2Cu + O2 ---to---> 2CuO (2)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT(1): \(n_{Fe}=n_{H_2}=0,3\left(mol\right)\)
=> \(m_{Fe}=0,3.56=16,8\left(g\right)\)
Ta có: \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
Theo PT(2): \(n_{Cu}=n_{CuO}=0,05\left(mol\right)\)
=> \(m_{Cu}=0,05.64=3,2\left(g\right)\)
=> \(\%_{m_{Cu}}=\dfrac{3,2}{3,2+16,8}.100\%=16\%\)
\(\%_{m_{Fe}}=100\%-16\%=84\%\)

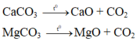
Gọi số mol C a C O 3 và M g C O 3 lần lượt là a và b mol
→ 100a + 84b = 30 (gam) (1)
Theo bài ra khối lượng chất rắn sau phản ứng là 30 : 2 = 15 gam
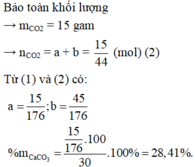
⇒ Chọn A.
