Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1)
Mg(OH)2 + H2SO4 => MgSO4 + 2H20
Bài 2)
sinh ra dd ko màu thì chỉ có Al2O3 thôi
Bài 3)
MgO + 2HNO3 => Mg(NO3)2 + H2O
Bài 4)
phương pháp hóa học
+ lấy hh Fe, Cu tác dụng với HCl
Fe +2 HCl => FeCl2 + H2
+ còn đồng ko tác dụng dc với HCl : ta lọc đồng ra khỏi hh òi phơi khô. Ta giả định cho đồng là 4g => mFe = 6g
% Cu = 4*100/10 = 40(%)
% Fe = 100- 40= 60 (%)
phương pháp vật lý
dùng nam châm hút sắt ra khỏi hỗn hợp. Ta có mFe là 6g => m Cu = 4 (g)
% Cu = 4*100/10 = 40(%)
% Fe = 100-40 = 60(%)

- 1 lượng Fe lần lượt tác dụng hết với axit sunfuric loãng, dư và axit sunfuric đặc nóng, dư
Fe + H2SO4 => FeSO4 + H2
1___________1_____________
2Fe + 6H2SO4 => Fe2(SO4)3 + 3SO2 + 6H2O
1_______________1,5________________
=> nH2 < nSO2
Nên lượng khí sinh ra khi cho Fe tác dụng với H2SO4 đặc nóng lớn hơn khi cho Fe tác dụng vs H2SO4 loãng

a) Khi cho khí \(SO_2\) vào dung dịch \(H_2SO_4\) sẽ không có hiện tượng gì xảy ra.
b) Khi để dung dịch \(H_2S\) ngoài không khí một thời gian thì trong ống nghiệm đựng dung dịch \(H_2S\) có xuất hiện kết tủa vàng \(\left(S\right)\) vì đã xảy ra phản ứng: \(H_2S+\frac{1}{2}O_2\rightarrow H_2O+S\downarrow\)
c) Khi nhỏ từ từ dung dịch \(H_2SO_4\) vào ống nghiệm chứa bột \(Na_2SO_3\) thì xuất hiện hiện tượng sủi bọt khí và khí bay ra có mùi hắc \(\left(SO_2\right)\)vì đã xảy ra phản ứng:
\(H_2SO_4+Na_2SO_3\rightarrow Na_2SO_4+H_2O+SO_2\uparrow\)
d) Khi cho dung dịch \(H_2SO_4\) loãng vào ống nghiệm chứa mẫu \(FeCl_2\) không xảy ra bất cứ hiện tượng gì.
e) Khi cho \(H_2SO_4\) đặc vào đường saccarozơ thì đường saccarozơ từ màu trắng chuyển sang màu đen, bắt đầu có cột đen đùn lên cao do xảy ra phản ứng:
\(C_{12}H_{22}O_{11}\underrightarrow{H_2SO_4\left(đ\right)}12C+11H_2O\\ C+2H_2SO_4\rightarrow CO_2+2SO_2+2H_2O\)

D sai
Muốn pha loãng axit sunfuric đặc, người ta rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh mà không làm ngược lại

a) CO2 + H2O -> H2CO3
N2O5 + H2O -> 2HNO3
b) Na2O + H2O -> 2NaOH
c) MgO + H2SO4 -> MgSO4 + H2O
Na2O + H2SO4 -> Na2SO4 + H2O
d) CO2 + Ca(OH)2 -> CaCO3 + H2O
e) CO2 + Na2O -> Na2CO3

\(n_{H_2}=\dfrac{0,784}{22,4}=0,035\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe + H2SO4 ---> FeSO4 + H2
a------------------------------>a
Zn + H2SO4 ---> ZnSO4 + H2
b---------------------------->b
\(\Rightarrow\left\{{}\begin{matrix}56a+65b=2,14\\a+b=0,035\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,015\left(mol\right)\\b=0,2\left(mol\right)\end{matrix}\right.\)
PTHH:
2Fe + 6H2SO4(đ, n) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,015--------------------------------------->0,0225
Zn + 2H2SO4(đ, n) ---> ZnSO4 + SO2 + 2H2O
0,02---------------------------------->0,02
=> VSO2 = (0,0225 + 0,02).22,4 = 0,952 (l)
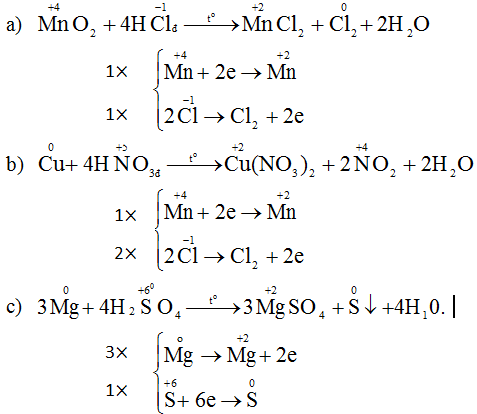
Chọn C
C a C O 3 + H 2 S O 4 ( l o ã n g ) → C a S O 4 + C O 2 + H 2 O
C a C O 3 + H 2 S O 4 ( đ ặ c ) → C a S O 4 + C O 2 + H 2 O