Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)H2S chỉ thể hiện tính khử vì số oxi hóa của S ở mức thấp nhất :-2 .(Không thể giảm nên chỉ có tình khử)
H2SO4 chỉ thể hiện tính oxi hóa vì số oxi hóa của S ở mức cao nhất :6 . (Không thể tăng nên chỉ có tính oxi hóa)
b)H2S + Pb(NO3)2-->PbS + 2HNO3
H2SO4+ FeS -->H2S + FeSO4

a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử còn H2SO4 chỉ thể hiện thính oxi hóa. Vì trong H2S số oxi hóa của (S-2) chỉ có thể tăng, trong H2SO4 số oxi hóa (S+6) chỉ có thể giảm.
b) Phương trình phản ứng hóa học:
2H2S + O2 -> 2H2O + 2S.
2 H2SO4 + Cu -> CuSO4 + SO2 + 2H2O
2 H2SO4 + KBr -> Br2 + SO2 + 2H2O + K2SO4

a) Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại giải phóng hiđro.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazơ và bazơ
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
- Tính chất với nhiều chất muối
BaCl2 + H2SO4 → BaSO4 +2HCl
b) Tính chất hóa học đặc trưng của axit sunfuric đặc là tính oxi hóa mạnh và tính háo nước.
- Tính chất oxi hóa mạnh
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
2H2SO4 + S → 3SO2 + 2H2O
2H2SO4 + 2KBr → Br2 + SO2 + 2H2O + K2SO4
- Tính háo nước và tính chất oxi hóa
Axit sunfuric đặc háp thụ mạnh nước. Axit sunfuric đặc chiếm các nguyên tử H và O là những nguyên tố thành phần của các hợp chất gluxit giải phóng cacbon và nước.
C12H22O11 → 12C + 11H2O.
Da thịt tiếp xúc với H2SO4 đặc sẽ bị bỏng rất nặng, vì vậy khi sử dụng axit sunfuric phải hết sức thận trọng
a) Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại giải phóng hiđro.
Fe + H2SO4 \(\rightarrow\) FeSO4 + H2
- Tác dụng với oxit bazơ và bazơ
Ba(OH)2 + H2SO4 \(\rightarrow\) BaSO4 + 2H2O
- Tính chất với nhiều chất muối
BaCl2 + H2SO4 \(\rightarrow\) BaSO4 +2HCl
b) Tính chất hóa học đặc trưng của axit sunfuric đặc là tính oxi hóa mạnh và tính háo nước.
- Tính chất oxi hóa mạnh
2H2SO4 + Cu \(\rightarrow\) CuSO4 + SO2 + 2H2O
2H2SO4 + S \(\rightarrow\) 3SO2 + 2H2O
2H2SO4 + 2KBr \(\rightarrow\) Br2 + SO2 + 2H2O + K2SO4
- Tính háo nước và tính chất oxi hóa
Axit sunfuric đặc háp thụ mạnh nước. Axit sunfuric đặc chiếm các nguyên tử H và O là những nguyên tố thành phần của các hợp chất gluxit giải phóng cacbon và nước.
C12H22O11 \(\rightarrow\) 12C + 11H2O.
Da thịt tiếp xúc với H2SO4 đặc sẽ bị bỏng rất nặng, vì vậy khi sử dụng axit sunfuric phải hết sức thận trọng.

Những phương trình phản ứng hóa học chứng minh:
a) Axit clohiđric tham gia phản ứng oxi hóa – khử với vai trò là chất khử:
b) Axit clohiđric tham gia phản ứng không oxi hóa – khử:
CaCO3 + 2HCl \(\rightarrow\) CaCl2 + CO2 + H2O.
CuO + 2HCl \(\rightarrow\) CuCl2 + H2O.

a) S + O2 → SO2 (Dựa vào tính khử của S)
SO2 + 2H2S → 2S + 2H2O (Dựa vào tính oxi hóa của SO2)
b) Tính khử của SO2
SO2 do nhà máy thải vào khí quyển. Nhờ xúc tác là oxit kim loại có trong khói bụi của nhà máy, nó bị O2 của không khí oxi hóa thành SO3
2SO2 + O2 → 2SO3
SO3 tác dụng với nước mưa thành mưa axit tạo ra H2SO4. Tính axit của H2SO4 đã phá hủy những công trình được xây bằng đá, thép.

a) Oxi và ozon đều có tính oxi hóa.
(1) Tác dụng với kim loại, oxi tác dụng với hầu hết các kim loại trừ Pt, Au, Ag... còn ozon tác dụng với hầu hết các kim loại trừ Au và Pt.
3Fe + 2O2 tocao→→tocao Fe3O4
2Ag + O3 -> Ag2O + O2
(2) Tác dụng với phi kim.
4P + 5O2 -> 2P2O5
2C + 2O3 -> 2CO2 + O2
(3) Tác dụng với nhiều hợp chất vô cơ, hữu cơ :
C2H5OH + 3O2 -> 2CO2 + 3H2O
2H2S + 3O2 -> 2SO2 + 2H2O
b) Ozon có tính oxi hóa mạnh hơn oxi.
- Oxi không tác dụng được với Ag, nhưng Ozon tác dụng được :
2Ag + O3 -> Ag2O + O2
O2 không oxi hóa được I- nhưng O3 oxi hóa được thành I2 :
2KI + O3 + H2O -> I2 + 2KOH + O2
-So với phân tử O2, phân tử O3 kém bền , dễ bị phân hủy .
O3 -> O2 + O ; 2O -> O2
Oxi dạng nguyên tử hoạt động mạnh hơn oxi dạng phân tử nên ozon hoạt động mạnh hơn oxi.
a) Oxi và ozon đều có tính oxi hóa.
(1) Tác dụng với kim loại, oxi tác dụng với hầu hết các kim loại trừ Pt, Au, Ag... còn ozon tác dụng với hầu hết các kim loại trừ Au và Pt.
3Fe + 2O2 tocao→→tocao Fe3O4
2Ag + O3 -> Ag2O + O2
(2) Tác dụng với phi kim.
4P + 5O2 -> 2P2O5
2C + 2O3 -> 2CO2 + O2
(3) Tác dụng với nhiều hợp chất vô cơ, hữu cơ :
C2H5OH + 3O2 -> 2CO2 + 3H2O
2H2S + 3O2 -> 2SO2 + 2H2O
b) Ozon có tính oxi hóa mạnh hơn oxi.
- Oxi không tác dụng được với Ag, nhưng Ozon tác dụng được :
2Ag + O3 -> Ag2O + O2
O2 không oxi hóa được I- nhưng O3 oxi hóa được thành I2 :
2KI + O3 + H2O -> I2 + 2KOH + O2
-So với phân tử O2, phân tử O3 kém bền , dễ bị phân hủy .
O3 -> O2 + O ; 2O -> O2
Oxi dạng nguyên tử hoạt động mạnh hơn oxi dạng phân tử nên ozon hoạt động mạnh hơn oxi.

4Mg +5H2SO4 đặc nóng =>4MgSO4 + H2S +4H2O
Tổng hệ số nguyên tối giản của các chất trong pt là 4+5+4+1+4=16
Tâm ơi , bn cộng nhầm rùi , là 18 chứ ko phải 16 .
cảm ơn bn đã trả lời câu hỏi giúp mình nhé .
![]()
![]()

Lưu huỳnh đioxit có thể tham gia các phản ứng sau :
SO2 + Br2 + 2H2O -> 2HBr + H2SO4 (1)
SO2 + 2H2O -> 3S + 2H2O (2)
Câu nào diễn tả không đúng tính chất hóa học của các chất trong những phản ứng trên ?
A.Phản ứng (1) : SO2 là chất khử, Br2 là chất oxi hóa.
B. Phản ứng (2) : SO2 là chất oxi hóa, H2S là chất khử.
C. Phản ứng (3) : SO2 vừa là chất khử, vừa là chất oxi hóa.
D. Phản ứng (1) : Br2 là chất oxi hóa, phản ứng (2) : H2S là chất khử.
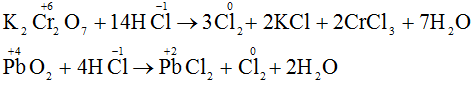
a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học: