Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. Fe + 2HCl => FeCl2 + H2
2Al + 6HCl => 2AlCl3 + 3H2
b. mCu= m kim loại ko tan =1,86
=> mFe + m Al = 6-1,86 =4,14
giải hệ 56x + 27y = 4,14
x + 3y/2 = 0,135
=> x= 0,045 y= 0,06
=> mFe = 2,52 m Al = 1,62
=> %Fe = 42%
%Al= 27%
%Cu = 31%

Cu + HCl →
2Al + 6HCl → 2AlCl3 + 3H2 ↑
0,5 0,75 (mol)
nH2 =\(\frac{16,8}{22,4}\) =0,75 (mol)
mAl =0,5 . 27= 13,5 (g)
%mAl =\(\frac{m_{Al}.100}{m_{hh}}\) = \(\frac{13,5.100}{16}\) = 84,375%
mCu =mhh -mAl =16 - 13,5 = 2,5%
%mCu =\(\frac{m_{Cu}.100}{m_{hh}}\) = \(\frac{2,5.100}{16}\) =15,625%

https://h.vn/hoi-dap/tim-kiem?q=H%C3%B2a+tan+4,54g+h%E1%BB%97n+h%E1%BB%A3p+Al,+Fe,+Cu+trong+dung+d%E1%BB%8Bch+HCl+d%C6%B0,+thu+%C4%91%C6%B0%E1%BB%A3c+1,792+l%C3%ADt+H2H2H_2(%C4%91ktc)+v%C3%A0+1,2g+kim+lo%E1%BA%A1i.+T%C3%ADnh+ph%E1%BA%A7n+tr%C4%83m+kh%E1%BB%91i+l%C6%B0%E1%BB%A3ng+m%E1%BB%97i+kim+lo%E1%BA%A1i+trong+h%E1%BB%97n+h%E1%BB%A3p+ban+%C4%91%E1%BA%A7u&id=689446
nhận xét Cu không tác dụng với HCl -> khí H2 sinh ra là do Fe và Al phản ứng vs HCl và 1,2 g kim loại của Cu
=> m Al + Fe = 4,54-1,2=3,34 g
n H2 = 1,792:22,4=0,08 mol
Gọi n cảu Al và Fe lần lượt là x và y
\(2Al+6HCl->2AlCl_3+3H_2\)
x...................................................................1,5x
\(Fe+2HCl->FeCl_2+H_2\)
y..................................................................y
ta có m Al + Fe = 27x + 56y =3,34 g
ta lại có n H2 = 1,5x+y=0,08 mol
=> x=0,02, y=0,05
m Al = 0,02.27=0,54 g
% Cu = \(\frac{1,2}{4,54}.100\%\approx26,43\%\)
% Al = \(\frac{0,54}{4,54}.100\%\approx11,89\%\)
% Fe = 100% - 26,43%-11,89% \(\approx\) 61,69%

Gọi số mol trong mỗi phần: Fe = x mol; M = y mol.
Phần 1:
Fe + 2HCl FeCl2 + H2
(mol): x x
2M + 2nHCl 2MCln + nH2
(mol): y 0,5ny
Số mol H2 = 0,07 nên x + 0,5ny = 0,07.
Phần 2:
2Fe + 6H2SO4 (đặc) Fe2(SO4)3 + 3SO2 + 6H2O
(mol): x 1,5x
2M + 2nH2SO4 (đặc) M2(SO4)n + nSO2 + 2nH2O
(mol): y 0,5nx
Số mol SO2 = 0,09 nên 1,5x + 0,5ny = 0,09. Vậy x = 0,04 và ny = 0,06.
Mặt khác: 56x + My = 2,78 nên My = 0,54. Vậy hay M = 9n.
Ta lập bảng sau:
| n | 1 | 2 | 3 |
| M | 9 ( loại ) | 18 ( loại ) | 27 ( nhận ) |
Vậy M là \(Al\) ( nhôm ) .
Đặt a là số mol Fe, b là số mol của M,trong mỗi phần,n là hóa trị của M
PTHH: Fe +2HCl ---> FeCl2 + H2
a a
2M + 2n HCl ---> 2 MCln + n H2
b bn/2
n H2= 0.07
---> a + bn/2 = 0.07 (1)
m hh A = 56a + Mb = 2.78 (2)
PTHH: Fe + 4HNO3 ----> Fe(NO3)3 + NO + 2H2O
a a
3M +4n HNO3 ---->3M(NO3)n +nNO + 2n H2O
b bn/3
n NO = a + bn/3 = 0.06 (3)
Từ (1) và (3) giải hệ ta dc : a= 0.04
bn = 0.06---> b= 0.06/n (4)
Thế à= 0.04vào pt (2) giải ra ta đc : 2.24 + Mb = 2.78
-----> b = 0.54/ M (5)
Từ (4) và (5) ----> M= 9n
Biện luận n
n=1 ----> M = 9 (loại)
n=2 ----> M= 18 (loại)
n=3-----> M=27 (nhận)
Do đó : M là Al

Cu không tác dụng với axit HCl , do đó chất không tan là Cu và m Cu = 2,5 (gam).
Khối lượng Al và Mg bằng : 12,7 - 2,5 = 10,2 (gam)
Phương trình hoá học của phản ứng :
2Al + 6HCl → 2 AlCl 3 + 3 H 2
Mg + 2HCl → MgCl 2 + H 2
Theo phương trình hoá học trên và dữ kiện đề bài cho, ta có :
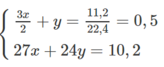
Giải ra, ta có : x = y = 0,2 mol
m Al = 0,2 x 27 = 5,4g
m Mg = 0,2 x 24 = 4,8g
% m Al = 5,4/12,7 .100% = 42,52%
% m Mg = 4,8/12,7 .100% = 37,8%
% m Cu = 100% - 42,52% - 37,8% = 19,68%

1/Gọi công thức oxit kim loại:MxOy
_Khi cho tác dụng với khí CO tạo thành khí CO2.
MxOy+yCO=>xM+yCO2
_Cho CO2 tác dụng với dd Ca(OH)2 tạo thành CaCO3:
nCaCO3=7/100=0.07(mol)=nCO2
CO2+Ca(OH)2=>CaCO3+H2O
0.07------------------>0.07(mol)
=>nO=0.07(mol)
=>mO=0.07*16=1.12(g)
=>mM=4.06-1.12=2.94(g)
_Lượng kim loại sinh ra tác dụng với dd HCl,(n là hóa trị của M)
nH2=1.176/22.4=0.0525(mol)
2M+2nHCl=>2MCln+nH2
=>nM=0.0525*2/n=0.105/n
=>M=28n
_Xét hóa trị n của M từ 1->3:
+n=1=>M=28(loại)
+n=2=>M=56(nhận)
+n=3=>M=84(loại)
Vậy M là sắt(Fe)
=>nFe=0.105/2=0.0525(mol)
=>nFe:nO=0.0525:0.07=3:4
Vậy công thức oxit kim loại là Fe3O4.
Khi hoà tan hợp kim gồm 3 kim loại Fe, Cu và Al trong dung dịch HCl dư thì Cu không tác dụng, khối lượng 1,86 gam là khối ỉượng Cu. Gọi số mol Fe là x mol, Al là y mol.
n Fe = x mol
n Al = y mol
n H 2 = 3,024/22,4 = 0,135
Ta có hệ phương trình
56x + 27y = 6 - 1,86 = 4,14
x + 3/2y = 0,135
=> x = 0,045; y = 0,06
m Fe = 0,045 x 56 = 2,52g; n Al = 0,06 x 27 = 1,62g
Từ đó ta tính được thành phần phần trăm khối lượng các kim loại.
nhờ sự giúp đỡ từ cđm ít thôi