Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Trong 140 gam dung dịch KClO3 bão hòa ở 80°C có 40 gam KClO3. Nên trong 350 gam dung dịch KClO3 bão hào ở 80°C có 100 gam KClO3.
Trong 108 gam dung dịch KClO3 bão hòa ở 20°C có 8 gam KClO3. Gọi số gam KClO3 tách ra khỏi dung dịch là a. Khi đó khối lượng dung dịch và khối lượng KClO3 trong dung dịch thu được lần lượt là 350 – a và 100 – a (gam).
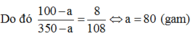

Gọi khối lượng NaCl trong 1900 gam dd NaCl bão hòa ở 90oC là a (gam)
Có: \(S_{NaCl\left(90^oC\right)}=\dfrac{a}{1900-a}.100=50\)
=> a = \(\dfrac{1900}{3}\left(g\right)\)
=> \(m_{H_2O}=1900-\dfrac{1900}{3}=\dfrac{3800}{3}\left(g\right)\)
Gọi khối lượng NaCl trong dd NaCl bão hòa ở 0oC là b (gam)
Có: \(S_{NaCl\left(0^oC\right)}=\dfrac{b}{\dfrac{3800}{3}}.100=35\)
=> \(b=\dfrac{1330}{3}\left(g\right)\)
=> mNaCl (tách ra) = \(\dfrac{1900}{3}-\dfrac{1330}{3}=190\left(g\right)\)
\(m_{NaCl\left(tách\right)}=m_{NaCl\left(dd.bão.hoà.90^oC\right)}-m_{NaCl\left(dd.bão.hoà.0^oC\right)}\\ =\dfrac{1900}{100}.50-\dfrac{1900}{100}.35=285\left(g\right)\)
Em xem có gì không hiểu thì hỏi lại nha!

Câu 1 :
$CuO + H_2SO_4 \to CuSO4 + H_2O$
n CuSO4 = n H2SO4 = n CuO = a(mol)
m dd H2SO4 = a.98/20% = 490a(gam)
m dd = 80a + 490a = 570a(gam)
n CuSO4.5H2O = 30,7/250 = 0,1228(mol)
Sau khi tách tinh thể :
n CuSO4 = a - 0,1228(mol)
m dd = 570a - 30,7(gam)
Áp dụng CT : C% = S/(S + 100) .100%. Ta có :
\(C\%_{CuSO_4} = \dfrac{160(a-0,1228)}{570a-30,7}.100\% = \dfrac{17,4}{100+17,4}.100\%\\ \Rightarrow a = 0,2(mol)\)
Câu 1.2 :
Gốc R đều là gốc no.
n CO2 = 13,44/22,4 = 0,6(mol)
n H2O = 10,44/18 = 0,58(mol)
Khi đốt cháy hợp chất hữu cơ chứa C,H,O , ta có :
n CO2 - n H2O = (k -1).n X , trong đó k là độ bất bão hòa
Ta thấy este có k = 3(3 liên kết pi trong gốc -COO-) , axit có k = 1( 1 liên kết pi trong gốc -COOH)
Do đó :
n CO2 - n H2O = 0,6 - 0,58 = (3 - 1).n este + (1 -1).n axit
Suy ra n este = 0,05(mol)
n este pư = 0,05.90% = 0,045(mol)
$(RCOO)_3C_3H_5 + 3NaOH \to 2RCOONa + C_3H_5(OH)_3$
n glixerol = n este pư = 0,045(mol)
m glixerol = 0,045.92 = 4,14(gam)

Ở 80 độ C, 192 gam KI tan trong 100 gam nước tạo 292 gam dung dịch bão hòa.
Suy ra 438 gam dung dịch bão hòa chứa
mKI=438.192\292=288 gam
→mH2O=438−288=150 gam
ở 20 độ C thì 144 gam KI tan trong 100 gam nước tạo dung dịch bão hòa
Suy ra 150 gam nước hòa tan được 144.150\100=216 gam KI.
→mKI tách ra=288−216=72 gam
Ở 80 độ C, 192 gam KI tan trong 100 gam nước tạo 292 gam dung dịch bão hòa.
Suy ra 438 gam dung dịch bão hòa chứa
\(m_{KI}=\frac{438.192}{292}=288\left(g\right)\)
\(\Rightarrow m_{H2O}=438-288=150\left(g\right)\)
Ở 20 độ C thì 144 gam KI tan trong 100 gam nước tạo dung dịch bão hòa
Suy ra 150 gam nước hòa tan được \(144.\frac{150}{100}=216\left(g\right)KI\)
\(\Rightarrow m_{KI\left(tach.ra\right)}=288-216=72\left(g\right)\)

Ta có: \(n_{SO_2}=\dfrac{12,395}{24,79}=0,5\left(mol\right)\)
BTNT S, có: nH2SO4 = nSO3 = nSO2 = 0,5 (mol)
Mà: mH2SO4 (ban đầu) = 210.10% = 21 (g)
⇒ mH2SO4 (trong X) = 21 + 0,5.98 = 70 (g)
Có: m dd X = 210 + mSO3 = 210 + 0,5.80 = 250 (g)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{70}{250}.100\%=28\%\)

\(n_{Mg}=\dfrac{10,8}{24}=0,45\left(mol\right)\)
PTHH: Mg + H2SO4 --> MgSO4 + H2
0,45-->0,45------>0,45--->0,45
=> \(m_{H_2SO_4}=0,45.98=44,1\left(g\right)\)
=> \(m_{ddH_2SO_4}=\dfrac{44,1.100}{20}=220,5\left(g\right)\)
mdd (20oC) = 10,8 + 220,5 - 0,45.2 - 14,76 = 215,64 (g)
\(m_{MgSO_4\left(dd.ở.20^oC\right)}=\dfrac{215,64.21,703}{100}=46,8\left(g\right)\)
=> nMgSO4 (tách ra) = \(0,45-\dfrac{46,8}{120}=0,06\left(mol\right)\)
=> nH2O (tách ra) = \(\dfrac{14,76-0,06.120}{18}=0,42\left(mol\right)\)
Xét nMgSO4 (tách ra) : nH2O (tách ra) = 0,06 : 0,42 = 1 : 7
=> CTHH: MgSO4.7H2O

Đặt công thức của tinh thể ngậm nước tách ra là MgSO4.nH2O
Trong 120 + 18n gam MgSO4.nH2O có 120 gam MgSO4 và 18n gam H2O
1,58 gam 0,237n gam
Khối lượng các chất trong 100 gam dung dịch bão hoà:
\(m_{H_2}=\frac{100.100}{35,1+100}=74,02g\)
\(m_{MgSO_4}=\frac{100.35,1}{35,1+100}\) = 25,98 gam
Khối lượng các chất trong dung dịch sau khi kết tinh:
\(m_{H_2O}\) = 74,02 – 0,237n gam
\(m_{MgSO_4}\)= 25,98 + 1 – 1,58 = 25,4 gam
Độ tan: s = \(\frac{25,4}{74,02-0,237n}.100=35,1\) . Suy ra n = 7.
Vậy công thức tinh thể ngậm nước kết tinh là MgSO4.7H2O

\(Q_{5,03\left(g\right)}=mc\Delta t=100cm^3\cdot0,9969g\cdot cm^{-3}\cdot4,2J\cdot g^{-1}\cdot K^{-1}\cdot\left(34,7-23\right)K\\ Q\approx4900J=4,9kJ\\ Q_{kJ\cdot mol^{-1}}=\dfrac{4,9kJ}{\dfrac{5,03g}{39g\cdot mol^{-1}}}=38kJ\cdot mol^{-1}\)