Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(CH_4+2O_2\rightarrow CO_2+2H_2O\\ n_{CH_4}=\dfrac{1}{2}n_{O_2}=\dfrac{1}{2}.\dfrac{2,128}{22,4}=0,0475\left(mol\right)\\ \%V_{CH_4}=\dfrac{0,0475.22,4}{1,12}.100=95\%\)

Đốt cháy hoàn toàn 28 lít hỗn hợp gồm CH4 và C2H2 trong đó CH4 chiếm 20% về thể tích. Hãy tính
a) Thể tích không khí cần dùng biết oxi chiếm 20% thể tích không khí
b) Thể tích khí CO2 tạo thành biết các khí đều đo ở đktc
-----------------------------
CH4 chiếm 20% trong 28 lit hỗn hợp
=> V CH4 = 20%.28 = 5,6 lit
=> nCH4 = V/22,4 = 0,25 mol
=> V C2H2 = 28 - 5,6 = 22,4 lit
=> n C2H2 = V/22,4 = 1 mol
CH4 + 2O2 ---------> CO2 + 2H2O
0,25 0,5 0,25
C2H2 + 5/2O2 -------------> 2CO2 + H2O
1 2,5 2
=> V kh + 2,5).100/20.22,4 = 336 lit
=> VCO2 = (0,25 + 2).22,4 = 50,4 lit

Bài 1 :
Sục mỗi khí qua dung dịch Ca(OH)2 dư :
- Vẩn đục : CO2
Hai khí còn lại dẫn qua dung dịch Br2 :
- Mất màu : C2H4
- Không HT : CH4
Ca(OH)2 + CO2 => CaCO3 + H2O
C2H4 + Br2 => C2H4Br2
Bài 2 :
\(n_{C_2H_4}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(C_2H_4+3O_2\underrightarrow{t^0}2CO_2+2H_2O\)
\(0.1.........0.3\)
\(V_{kk}=5V_{O_2}=5\cdot22.4\cdot0.3=33.6\left(l\right)\)

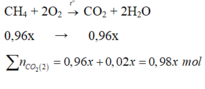
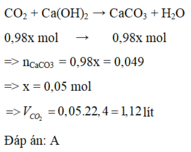

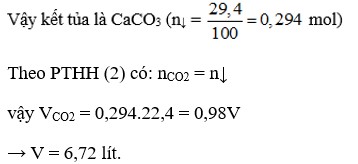
\(V_{CH_4} = 100.96\% = 96(lít)\\ V_{CO_2} = 100.2\% = 2(lít)\\ CH_4 + O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ \)
Ta có :
\(V_{CO_2\ thải\ ra} = V_{CH_4} + V_{CO_2} = 96 + 2 = 98(lít)\)
\(\%V_{CH_4}=96\left(l\right)\)
\(CH_4+O_2\rightarrow CO_2+2H_2O\)
- Thấy cứ 1l CH4 tạo ra 1l CO2
=> 96l CH4 tạo ra x l CO2 .
=> X = 96 ( l )
Vậy cứ đốt 100 lít khí thiên nhiên sẽ thải ra 96l khí CO2